小鼠小肠类器官培养实验操作流程及注意事项
2025-11-20 来源:本站 点击次数:118
想象一下,在实验室里培养出一个拥有完整结构的"迷你小肠"或"微型大脑"?这不是科幻!类器官——这种神奇的"迷你器官",正让这一切成为现实,为疾病研究、新药研发打开了一扇全新的大门。
Section.01
类器官:研究背景
类器官是什么?
类器官是源自干细胞或器官祖细胞的三维细胞聚集体。它能模拟真实器官的关键功能和复杂结构,用来进行疾病研究或药物测试,结果比传统方法更接近体内的真实情况[1]。
类器官培养的意义是什么?
类器官的开发对人体器官和组织功能的研究意义重大。这得益于这些微型器官能够很好地展现人体生物学特性[2]。
小鼠小肠类器官被视为最经典和成熟的类器官模型之一,这一定位根植于 Hans Clevers 教授团队 2009 年的开创性工作。该团队首次实现了成年小肠干细胞在体外的类器官培养,为此领域的蓬勃发展奠定了基础。小鼠小肠类器官广泛应用于基础研究、药物筛选、宿主-微生物互作、疾病建模等领域。与传统的二维 (2D) 培养系统相比,3D 类器官培养提供了一个更具生理相关性的模型[3][4]。
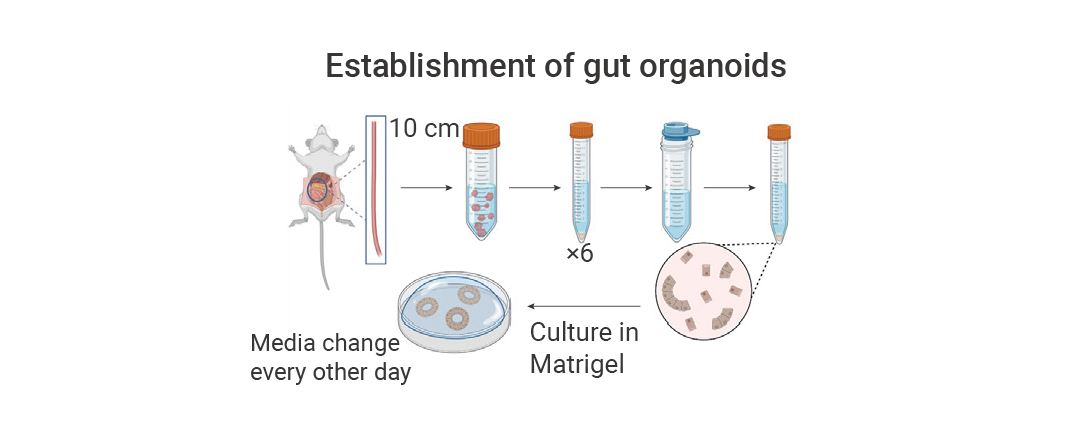 图 1. 已建立的小鼠小肠类器官培养方法[5]。
图 1. 已建立的小鼠小肠类器官培养方法[5]。
类器官技术为核心疾病建模与个体化治疗提供了强大平台。该类模型能够高度模拟出生缺陷、癌症、传染病、代谢性疾病等条件下的器官发育与疾病演进过程。例如,血管类器官已被应用于揭示糖尿病血管功能障碍的相关分子通路。在药物研发领域,类器官与器官芯片技术有望共同减少对传统动物模型的依赖,广泛应用于药物筛选、毒理与药理评估,最终推动个体化治疗的实现[6][7][8]。
Section.02
小肠类器官:培养指南
将 Lgr5+ 肠道干细胞包埋于基质胶中,并利用含有 WENR (Wnt3a, EGF, Noggin, R-spondin 1) 因子的培养基进行培养,就成功构建了肠道类器官模型。该模型不仅能实现干细胞的无限增殖,还再现了肠道上皮的细胞多样性,从而为原位、实时观察上皮发育与分化提供了理想平台[9][10]。
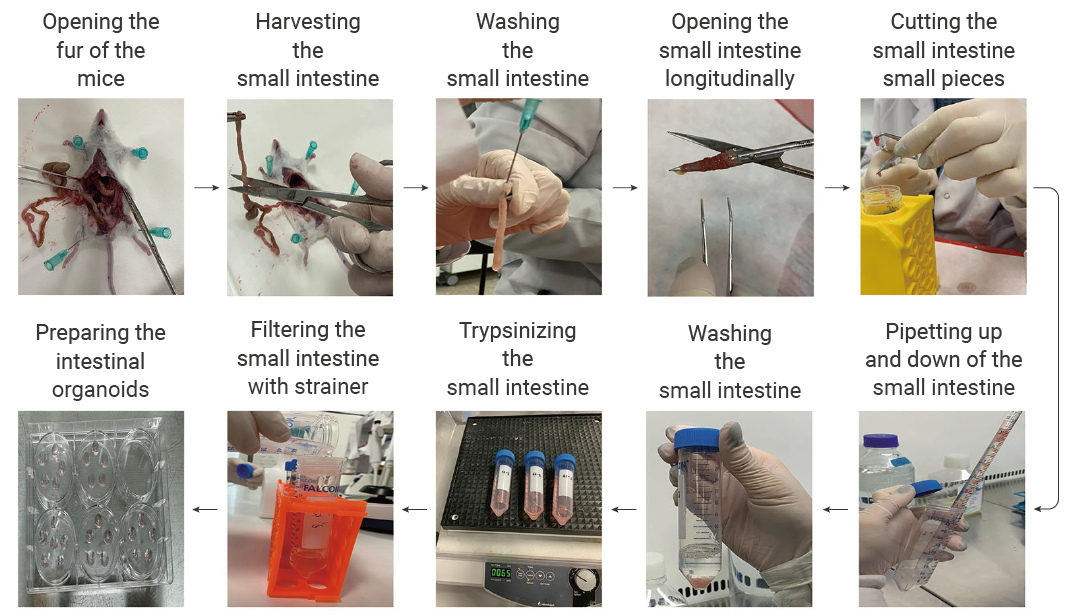 图 2. 从小鼠肠道隐窝生成类器官的步骤流程[9]。
图 2. 从小鼠肠道隐窝生成类器官的步骤流程[9]。
实验步骤:
1. 小鼠肠隐窝的分离
(1) 将小鼠禁食过夜或禁食 24 小时,用二氧化碳窒息法对 5 至 8 周龄小鼠实施安乐死,在分离小肠和结肠之前,用 70% 乙醇擦拭小鼠皮毛进行消毒。
(2) 切取约 18-20 cm 长的近端小肠段。对于结肠部分,应解剖约 3–6 cm 的肠段,切割位置宜选择在盲肠下方数毫米及直肠上方数毫米处,以避免引入过多毒素及代谢废物污染培养体系,同时考虑到近端结肠区域具有较高的干细胞密度。随后,使用镊子仔细清除肠段表面附着的脂肪残留、血管及外膜组织。
(3) 将分离的肠段小心地放入一个 10 厘米的细胞培养皿中,培养皿中应加入 10 mL 预冷 PBS,用 10 mL 毫升注射器和 21G 针头,用预冷的 PBS 轻轻冲洗肠腔,直至所有粪便颗粒都被排出。
(4) 用剪刀纵向剪开肠段,使之形成肠片,用预冷的 PBS 轻轻冲洗肠片。
(5) 将肠段切成约 2-5 mm 的小块,转移到装有 25 mL 预冷 PBS 的 50 mL 离心管中。
(6) 用血清移液管轻柔地吹打肠段小块五次。让样本静置约 20 秒,使组织碎片依靠重力自然沉降到管底。
(7) 待碎片沉降后,弃去 PBS。然后,向离心管中重新加入 25 mL 预冷 PBS,重复步骤 (6) 和 (7) 直到剩余的 PBS 变得清澈透明为止。
(8) 弃去清澈的 PBS,将组织碎片重悬于 20 mL 0.05% 的胰蛋白酶 /EDTA 溶液中。将样本在 37 ℃、转速为 20 rpm 的旋转摇床上孵育 20 分钟。
(9) 弃去胰蛋白酶 /EDTA 溶液,用 10 mL 预冷的 0.1% BSA 溶液重悬碎片。用预先润湿的血清移液管轻柔地吹打碎片三次。
(10) 让组织碎片自然沉降后,将样本的上清液部分通过一个 70 μm 的细胞筛网过滤,收集第一部分滤液。
(11) 向剩余的组织沉淀中加入 10 mL 0.1% BSA 溶液,用预先润湿的血清移液管轻柔地吹打碎片三次。重复步骤 (10),收集第二部分滤液。
(12) 重复步骤 (9)(10)(11),直至收集第五部分滤液。
(13) 将第四和第五部分滤液在 4-6 ℃、转速为 300 g 的条件下离心 5 分钟。弃去上清,将含有肠道隐窝的沉淀重悬于 5 mL DMEM/Nutrient Mixture F-12 培养基中。
(14) 取部分滤液样本转移到六孔板中,在倒置光学显微镜下观察隐窝的质量。
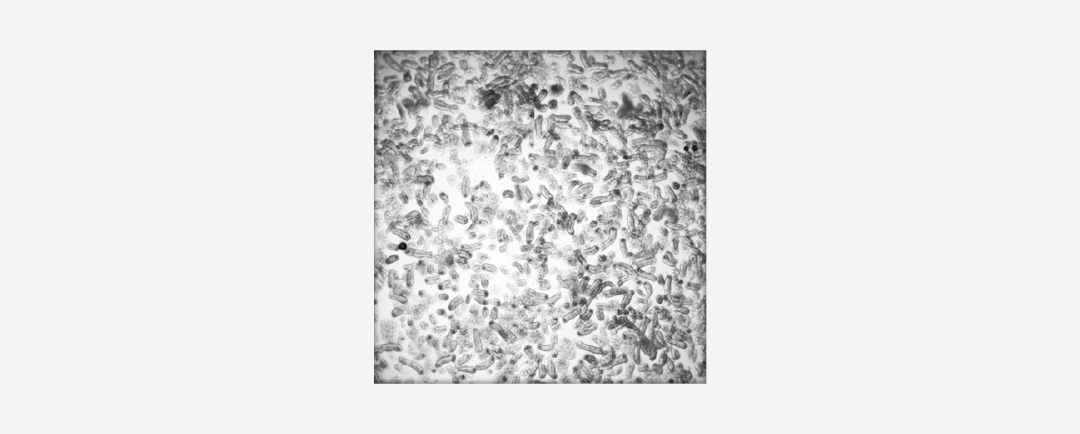 图 3. 小鼠分离肠隐窝的样本图像[4]。
图 3. 小鼠分离肠隐窝的样本图像[4]。
2. 从分离的小鼠肠隐窝中制备肠类器官
(1) 将隐窝重悬于 DMEM/Nutrient Mixture F-12 后,用预先润湿的微量移液器吸头吸取 10 微升样本,滴加到细胞计数板上,计数分离物中的隐窝数量。
(2) 将隐窝分离物在 4-6 ℃、300 g 的条件下离心 5 分钟,弃去上清。
(3) 将隐窝分离物重悬于 180 μL 的小鼠肠道类器官生长培养基和基质胶的 1:1 混合液中,并使用剪口吸头充分混匀。
(4) 用剪口微量移液器吸头,将培养基-基质胶混合液 (每滴 30 μL) 滴加到六孔板的一个孔中,形成液滴穹顶,并将隐窝分离物包埋其中。
(5) 轻轻将培养板翻转,在 37 ℃、5% CO2、80% 相对湿度的 CO2 培养箱中孵育 30 分钟,使基质胶聚合。
(6) 沿孔壁缓慢加入 2 mL 小鼠肠道类器官生长培养基。然后将培养板放入 CO2 培养箱中培养。
(7) 每天更换培养基,直到类器官完全发育成熟。
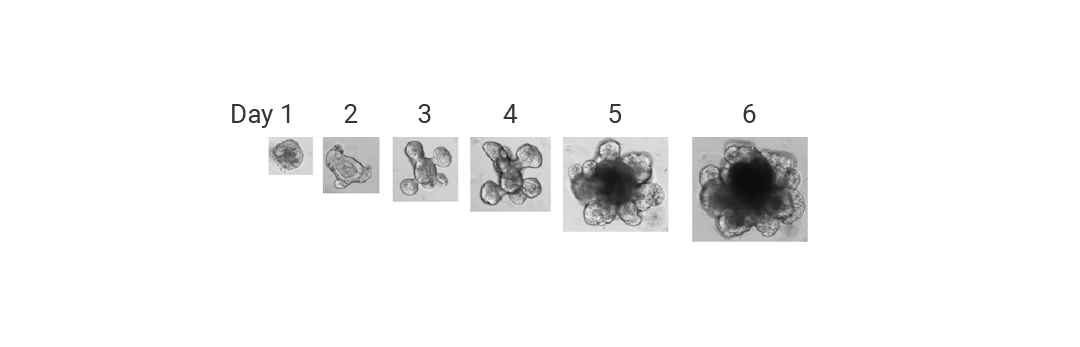 图 4. 肠类器官的形态发展[4]。
图 4. 肠类器官的形态发展[4]。
Section.03
小肠类器官培养:注意事项
1. 如果使用 0.25% 胰蛋白酶 /EDTA,则必须进一步稀释,以避免组织中的细胞损坏。
2. 与小肠相比,结肠中的肠道干细胞密度较低,因此建议使用两个以上的结肠以提高细胞密度。
3. 小鼠肠道一定要剪的足够碎,否则会影响隐窝的提取。
4. 血清移液器必须预先润湿,以防止肠碎片或肠隐窝粘附在移液器壁上。建议事先用 PBS 上下移液,作为润湿步骤。
5. 基质胶一定要在冰上操作,室温下很容易变稠或凝固。基质胶与隐窝混悬时吹打也一定要轻柔,一旦混入气泡,后期培养过程中很容易出现散胶甚至溶胶的现象。
6. 加培养基时,请勿直接滴加在基质胶滴上,以免破坏胶滴。培养基在使用前也一定要恢复室温,冷藏的培养基直接加入到培养孔中很容易破坏胶滴。
7. 为了加速 Matrigel 的完全凝固,可以预先将培养板在 37℃ 的 CO2 培养箱中加热。
8. 类器官构建后,类器官的表征是非常重要的,在鉴定类器官后可进行下游应用。初步可以通过显微镜和 H&E 染色观察形态;然后可以用 Western Blot、qRT-PCR、免疫荧光、流式细胞术检测该类器官是否表达相应的 biomarker;基因测序可以鉴定所培养的类器官是否有某些特征丢失;对于部分类器官,还可以检测其是否具有功能。
Section.04
小结
小鼠小肠类器官是一项革命性技术,通过在体外三维培养中模拟真实肠道结构,为疾病研究、药物筛选及发育生物学提供了无比接近体内环境的强大平台。成功培养小鼠小肠类器官,是精密操作、优质基质胶与含有核心因子培养基三者结合的艺术。掌握其原理并严格把控细节,您就能在培养皿中重现一个生机勃勃的“迷你肠道”。

[1] Madeline A Lancaster, et al. Organogenesis in a dish: modeling development and disease using organoid technologies. Science. 2014 Jul 18;345(6194):1247125.
[2] Hans Clevers, et al. Optimization of human small intestinal organoids. 23 August 2022.
[3] Toshiro Sato, et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 2009 May 14;459(7244):262-5.
[4] Lei Chen, et al. Mouse Small Intestinal Organoid Cultures. Methods Mol Biol. 2025:2951:77-90.
[5] Marta Campillo Poveda, et al. Generation, culture, and stimulation of small intestinal murine organoids in parasitology research. STAR Protoc. 2023 Dec 15;4(4):102608.
[6] Katia Cheaito, et al. Establishment and characterization of prostate organoids from treatment-na?ve patients with prostate cancer. Oncol Lett. 2022 Jan;23(1):6.
[7] Sarah E Blutt, et al. Organoid Models for Infectious Disease. Annu Rev Med. 2022 Jan 27:73:167-182.
[8] Reiner A Wimmer, et al. Human blood vessel organoids as a model of diabetic vasculopathy. Nature. 2019 Jan;565(7740):505-510.
[9] ?züm Begüm B?ke, et al. Mouse Intestinal Organoid Culture Protocol. Methods Mol Biol. 2025 Jan 9.
[10] Magdalena Kasendra, et al. Development of a primary human Small Intestine-on-a-Chip using biopsy-derived organoids. Sci Rep. 2018 Feb 13;8(1):2871.


Section.01
类器官:研究背景
类器官是什么?
类器官是源自干细胞或器官祖细胞的三维细胞聚集体。它能模拟真实器官的关键功能和复杂结构,用来进行疾病研究或药物测试,结果比传统方法更接近体内的真实情况[1]。
类器官培养的意义是什么?
类器官的开发对人体器官和组织功能的研究意义重大。这得益于这些微型器官能够很好地展现人体生物学特性[2]。
小鼠小肠类器官被视为最经典和成熟的类器官模型之一,这一定位根植于 Hans Clevers 教授团队 2009 年的开创性工作。该团队首次实现了成年小肠干细胞在体外的类器官培养,为此领域的蓬勃发展奠定了基础。小鼠小肠类器官广泛应用于基础研究、药物筛选、宿主-微生物互作、疾病建模等领域。与传统的二维 (2D) 培养系统相比,3D 类器官培养提供了一个更具生理相关性的模型[3][4]。
 图 1. 已建立的小鼠小肠类器官培养方法[5]。
图 1. 已建立的小鼠小肠类器官培养方法[5]。类器官技术为核心疾病建模与个体化治疗提供了强大平台。该类模型能够高度模拟出生缺陷、癌症、传染病、代谢性疾病等条件下的器官发育与疾病演进过程。例如,血管类器官已被应用于揭示糖尿病血管功能障碍的相关分子通路。在药物研发领域,类器官与器官芯片技术有望共同减少对传统动物模型的依赖,广泛应用于药物筛选、毒理与药理评估,最终推动个体化治疗的实现[6][7][8]。
Section.02
小肠类器官:培养指南
将 Lgr5+ 肠道干细胞包埋于基质胶中,并利用含有 WENR (Wnt3a, EGF, Noggin, R-spondin 1) 因子的培养基进行培养,就成功构建了肠道类器官模型。该模型不仅能实现干细胞的无限增殖,还再现了肠道上皮的细胞多样性,从而为原位、实时观察上皮发育与分化提供了理想平台[9][10]。
 图 2. 从小鼠肠道隐窝生成类器官的步骤流程[9]。
图 2. 从小鼠肠道隐窝生成类器官的步骤流程[9]。实验步骤:
1. 小鼠肠隐窝的分离
(1) 将小鼠禁食过夜或禁食 24 小时,用二氧化碳窒息法对 5 至 8 周龄小鼠实施安乐死,在分离小肠和结肠之前,用 70% 乙醇擦拭小鼠皮毛进行消毒。
(2) 切取约 18-20 cm 长的近端小肠段。对于结肠部分,应解剖约 3–6 cm 的肠段,切割位置宜选择在盲肠下方数毫米及直肠上方数毫米处,以避免引入过多毒素及代谢废物污染培养体系,同时考虑到近端结肠区域具有较高的干细胞密度。随后,使用镊子仔细清除肠段表面附着的脂肪残留、血管及外膜组织。
(3) 将分离的肠段小心地放入一个 10 厘米的细胞培养皿中,培养皿中应加入 10 mL 预冷 PBS,用 10 mL 毫升注射器和 21G 针头,用预冷的 PBS 轻轻冲洗肠腔,直至所有粪便颗粒都被排出。
(4) 用剪刀纵向剪开肠段,使之形成肠片,用预冷的 PBS 轻轻冲洗肠片。
(5) 将肠段切成约 2-5 mm 的小块,转移到装有 25 mL 预冷 PBS 的 50 mL 离心管中。
(6) 用血清移液管轻柔地吹打肠段小块五次。让样本静置约 20 秒,使组织碎片依靠重力自然沉降到管底。
(7) 待碎片沉降后,弃去 PBS。然后,向离心管中重新加入 25 mL 预冷 PBS,重复步骤 (6) 和 (7) 直到剩余的 PBS 变得清澈透明为止。
(8) 弃去清澈的 PBS,将组织碎片重悬于 20 mL 0.05% 的胰蛋白酶 /EDTA 溶液中。将样本在 37 ℃、转速为 20 rpm 的旋转摇床上孵育 20 分钟。
(9) 弃去胰蛋白酶 /EDTA 溶液,用 10 mL 预冷的 0.1% BSA 溶液重悬碎片。用预先润湿的血清移液管轻柔地吹打碎片三次。
(10) 让组织碎片自然沉降后,将样本的上清液部分通过一个 70 μm 的细胞筛网过滤,收集第一部分滤液。
(11) 向剩余的组织沉淀中加入 10 mL 0.1% BSA 溶液,用预先润湿的血清移液管轻柔地吹打碎片三次。重复步骤 (10),收集第二部分滤液。
(12) 重复步骤 (9)(10)(11),直至收集第五部分滤液。
(13) 将第四和第五部分滤液在 4-6 ℃、转速为 300 g 的条件下离心 5 分钟。弃去上清,将含有肠道隐窝的沉淀重悬于 5 mL DMEM/Nutrient Mixture F-12 培养基中。
(14) 取部分滤液样本转移到六孔板中,在倒置光学显微镜下观察隐窝的质量。
 图 3. 小鼠分离肠隐窝的样本图像[4]。
图 3. 小鼠分离肠隐窝的样本图像[4]。2. 从分离的小鼠肠隐窝中制备肠类器官
(1) 将隐窝重悬于 DMEM/Nutrient Mixture F-12 后,用预先润湿的微量移液器吸头吸取 10 微升样本,滴加到细胞计数板上,计数分离物中的隐窝数量。
(2) 将隐窝分离物在 4-6 ℃、300 g 的条件下离心 5 分钟,弃去上清。
(3) 将隐窝分离物重悬于 180 μL 的小鼠肠道类器官生长培养基和基质胶的 1:1 混合液中,并使用剪口吸头充分混匀。
(4) 用剪口微量移液器吸头,将培养基-基质胶混合液 (每滴 30 μL) 滴加到六孔板的一个孔中,形成液滴穹顶,并将隐窝分离物包埋其中。
(5) 轻轻将培养板翻转,在 37 ℃、5% CO2、80% 相对湿度的 CO2 培养箱中孵育 30 分钟,使基质胶聚合。
(6) 沿孔壁缓慢加入 2 mL 小鼠肠道类器官生长培养基。然后将培养板放入 CO2 培养箱中培养。
(7) 每天更换培养基,直到类器官完全发育成熟。
 图 4. 肠类器官的形态发展[4]。
图 4. 肠类器官的形态发展[4]。Section.03
小肠类器官培养:注意事项
1. 如果使用 0.25% 胰蛋白酶 /EDTA,则必须进一步稀释,以避免组织中的细胞损坏。
2. 与小肠相比,结肠中的肠道干细胞密度较低,因此建议使用两个以上的结肠以提高细胞密度。
3. 小鼠肠道一定要剪的足够碎,否则会影响隐窝的提取。
4. 血清移液器必须预先润湿,以防止肠碎片或肠隐窝粘附在移液器壁上。建议事先用 PBS 上下移液,作为润湿步骤。
5. 基质胶一定要在冰上操作,室温下很容易变稠或凝固。基质胶与隐窝混悬时吹打也一定要轻柔,一旦混入气泡,后期培养过程中很容易出现散胶甚至溶胶的现象。
6. 加培养基时,请勿直接滴加在基质胶滴上,以免破坏胶滴。培养基在使用前也一定要恢复室温,冷藏的培养基直接加入到培养孔中很容易破坏胶滴。
7. 为了加速 Matrigel 的完全凝固,可以预先将培养板在 37℃ 的 CO2 培养箱中加热。
8. 类器官构建后,类器官的表征是非常重要的,在鉴定类器官后可进行下游应用。初步可以通过显微镜和 H&E 染色观察形态;然后可以用 Western Blot、qRT-PCR、免疫荧光、流式细胞术检测该类器官是否表达相应的 biomarker;基因测序可以鉴定所培养的类器官是否有某些特征丢失;对于部分类器官,还可以检测其是否具有功能。
Section.04
小结
小鼠小肠类器官是一项革命性技术,通过在体外三维培养中模拟真实肠道结构,为疾病研究、药物筛选及发育生物学提供了无比接近体内环境的强大平台。成功培养小鼠小肠类器官,是精密操作、优质基质胶与含有核心因子培养基三者结合的艺术。掌握其原理并严格把控细节,您就能在培养皿中重现一个生机勃勃的“迷你肠道”。
|
产品推荐 |
|
MCE ATP 发光法 3D 细胞活力检测试剂盒 (HY-K6017) MCE ATP 发光法 3D 细胞活力检测试剂盒基于高灵敏度生物发光检测技术 (荧光素酶系统),通过对 ATP 进行定量以测定培养物中 3D 细胞数目及细胞活力。 |
|
MCE 类器官分离液是一种即用型类器官分离液,可将类器官从基质胶中分离并回收完整的类器官,广泛应用于基于基质胶培养的类器官的分离消化过程。 |
|
MCE 类器官基底膜基质胶主要成分是小鼠肿瘤中提取的天然基底膜基质,主要用于培养类器官。 |
|
MCE 类器官冻存液是一种即用型类器官冻存液,可广泛应用于多种哺乳动物 (如人、鼠、猪、牛等) 来源的类器官和细胞系的冻存。 |
|
MCE 人小肠类器官培养试剂盒包含小肠类器官基础培养基 A 以及培养添加物 B (50x),培养添加物 C (250x) 和培养添加 D (250x)。该产品可有效构建人小肠类器官。 |

[1] Madeline A Lancaster, et al. Organogenesis in a dish: modeling development and disease using organoid technologies. Science. 2014 Jul 18;345(6194):1247125.
[2] Hans Clevers, et al. Optimization of human small intestinal organoids. 23 August 2022.
[3] Toshiro Sato, et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 2009 May 14;459(7244):262-5.
[4] Lei Chen, et al. Mouse Small Intestinal Organoid Cultures. Methods Mol Biol. 2025:2951:77-90.
[5] Marta Campillo Poveda, et al. Generation, culture, and stimulation of small intestinal murine organoids in parasitology research. STAR Protoc. 2023 Dec 15;4(4):102608.
[6] Katia Cheaito, et al. Establishment and characterization of prostate organoids from treatment-na?ve patients with prostate cancer. Oncol Lett. 2022 Jan;23(1):6.
[7] Sarah E Blutt, et al. Organoid Models for Infectious Disease. Annu Rev Med. 2022 Jan 27:73:167-182.
[8] Reiner A Wimmer, et al. Human blood vessel organoids as a model of diabetic vasculopathy. Nature. 2019 Jan;565(7740):505-510.
[9] ?züm Begüm B?ke, et al. Mouse Intestinal Organoid Culture Protocol. Methods Mol Biol. 2025 Jan 9.
[10] Magdalena Kasendra, et al. Development of a primary human Small Intestine-on-a-Chip using biopsy-derived organoids. Sci Rep. 2018 Feb 13;8(1):2871.


相关文章
更多 >

