准确解读细胞死亡实验结果的技巧分享
2023-12-26 来源: 点击次数:1675摘要:细胞死亡是一个重要的生物过程,其检测和测量过程困难,尤其是在多种检测条件同时进行时。由于测量技术的复杂性和该领域标准化方法的缺乏,细胞死亡数据的解读变得更加复杂。本文提供更多提示来帮助解释细胞死亡实验。
关键词:细胞死亡、数据解读、细胞增殖、细胞死亡机制、细胞分析、细胞生物学、细胞计数、活细胞成像
《Nature Cell Biology》期刊在2023年11月发表了一篇名为《Quick tips for interpreting cell death experiments》[1]的文章,文中列举了解读细胞死亡实验结果的多个技巧。
细胞死亡是动物发育和维持体内稳态至关重要的环节,许多研究试图了解细胞死亡是如何被调节的,也有研究试图找到能够触发或防止细胞死亡的药物。测量细胞死亡并清楚地呈现细胞死亡过程是一个艰巨的挑战。这篇综述提供了一些技巧来帮助解释已发表的细胞死亡实验的结果。重点在于培养细胞中进行的机制实验,在两种或两种以上的条件下比较细胞死亡的数量,这是许多研究中常见的实验方式。这些技巧是根据作者自己的研究、所遇到的问题和失误,以及尽可能仔细地测量细胞死亡而做出的努力得出的。
Tip1:如何检测细胞死亡
活细胞、濒死细胞和死细胞都会产生许多信号,通过这些信号可直接检测或间接推断细胞死亡(图1a,b),重要的是要注意不同技术是如何检测细胞死亡的。例如,使用流式细胞术或图像法直接对群体中的单个活细胞和/或死细胞进行计数。然而,许多研究中用来推断细胞死亡的依据是群体中所有细胞获得的大量代谢物,例如还原四唑基化合物(如使用MTT试剂盒)或测量总ATP丰度(如使用CellTiter-Glo)。虽然代谢数据相对简单且易于拓展到大量样品,但这些方法不能直接测量细胞死亡且会受到技术干扰(例如在细胞凋亡早期,线粒体损伤会改变新陈代谢、增加ATP水平,与细胞死亡无关[2]),在进行这些操作时,减缓新陈代谢但不杀死细胞的情况也可能引起误解。监测细胞死亡途径特异性生化变化(如凋亡过程中线粒体内膜跨膜电位的丧失)可能有助于分析细胞死亡机制的诱发情况,但仍会受到其他限制,下文将进行解析。
Tip2:如何分析细胞死亡
细胞死亡研究的常见比较方法是阴性对照与一种或多种处理条件之间进行对比(图1c)。如上文所述,需要注意的是监测细胞死亡还是推断细胞死亡。在使用大量代谢物进行检测时,无法辨别治疗处理是否会导致细胞死亡、减缓细胞增殖或导致这些效应的某种组合情况发生(图1d),当长时间处理细胞时这一问题尤为突出,持续增殖、增殖停止或细胞死亡的综合情况可能会发生。此外,只知道活细胞数或死细胞数难以了解药物效果,例如,一个样本起初有100个活细胞,后来有100个死细胞和0个活细胞,这与一个样本起初有100个活细胞,后来有100个死细胞和400个活细胞是不同的。我们需要知道在实验开始时的活细胞数以及在实验结束时的活细胞数和死细胞数,才能清楚地了解特定治疗的效果[3,4]。
Tip3:考虑时间对结果的影响
细胞死亡是随时间推移而发生的过程,在最终导致细胞死亡信号到达和实际质膜破裂之间通常会发生一段信号转导期,这个时间可以从几分钟、几小时、或到几天不等,这是致命刺激的性质[5](图1d)影响而造成的。因此,重要的是要注意何时进行细胞死亡测量。通常会使用一个任意的终点(例如,6、24或48小时)。重要的是要考虑终点的选择是否有生物学依据,以及如果提前或推迟测量结果会是怎样。某些细胞死亡抑制剂或基因操作可能并不能完全阻止细胞死亡,而只是改变了细胞死亡的时间[3]。因此,理想情况下细胞死亡是随着时间的推移而测量的。在采用终点检测法时,合理选择时间点至关重要。
在质膜破裂后的某个时刻,原始细胞物质可能会完全解体(图1a),这可能将导致对细胞死亡的误解。相对于细胞群中细胞死亡的开始时间而言,过晚地测量可能意味着只有少量死亡细胞能保持足够的完整性,无法通过任何方式对其进行计数。如果一种扰动迅速杀死了一些细胞,但剩余的活细胞继续增殖直到较晚的实验终点,这可能会掩盖早期的细胞死亡效应,并导致一种“幸存者偏差”,即特定处理的致死效应被忽视。对群体中的细胞死亡进行延时测量有助于改善这些问题[3,4]。
Tip4:考虑细胞增殖对数据解释的影响(第一部分)
特别是在使用终点法测定细胞活力时,细胞增殖可能会影响对细胞死亡的检测和解释。[6]在对照条件下的活细胞数量通常会在实验开始和结束之间会迅速增加。在已发表的研究中频繁使用24或48小时作为时间终点的部分原因是需要在这些细胞本身密度过大导致细胞死亡之前从对照条件中捕获数据(图1d)。更重要的是,相对于任何处理过的细胞群体,对照细胞群体的无限增殖可能无意中导致被误解为对细胞死亡的影响(图1d)[7]。
细胞增殖不会因许多致命的刺激而停止,在细胞死亡开始前的几个小时内,活细胞的数量反而会继续增加(图1d)[3]。另一方面,DNA损伤或生长因子信号的抑制可引起双相反应,即细胞首先停止增殖,之后不再增殖的细胞发生死亡[8]。这些动态很难用任何类型的终点分析来捕捉且不能轻易区分增殖停止和细胞死亡的大量代谢。随着时间的推移,直接计数活细胞和死细胞的技术可以帮助捕捉这些效应,并将细胞死亡归一化到一个群体中观察到的起始或max活细胞数[3,4]。还开发了一些特殊的指标来衡量细胞增殖和细胞死亡是如何协调的,并有助于解释群体水平上的细胞死亡[7]。
Tip5:考虑细胞增殖对数据解释的影响(第二部分)
同时检查一种处理对许多不同细胞系的影响是非常常见的。细胞系之间细胞增殖速率的差异会很大程度地影响对这些数据的解释。尤其在批量测定细胞活力时,相比于增殖较快的细胞,生长较慢的细胞通常对治疗诱导的细胞死亡表现出更强的抵抗力。HER2阳性乳腺癌细胞往往比培养的其他乳腺癌细胞增殖得更慢,因此传统的测量方法无法捕捉到这些细胞对HER2抑制剂的独特敏感性。归一化方法可以减轻生长速率变化的混杂效应,更准确地测量处理因素诱导的细胞死亡[8,9]。
Tip6:数据规范化
细胞活力或细胞死亡通常以标准化和简化的模式呈现(例如0到1或0%到100%的细胞死亡)。当使用大量代谢物计算时,通常减去培养基或培养容器产生的背景信号来对结果进行归一化处理,然后将实验组与阴性对照组进行比对。“细胞活力”降低50%可能表示所有细胞的增殖速度减慢50%,也可能表示群体中某些细胞死亡而其他细胞存活并增殖。
在一些研究中,结果被进一步抽象为相对于对照组的“细胞死亡百分比变化”。如果没有进一步的信息,就无法获知细胞群中多少细胞死亡。“细胞死亡增加100%”可以解释为2%和4%的死亡细胞之间的差异,也可能意味着40%和80%的死亡细胞之间的差异。这种形式的数据归一化可能会影响我们对生物效应的判断。其他的简化方法,如以热图形式显示汇总数据,可以简明扼要地传达许多观测值。这些描述只显示了平均值,不同条件下存在的生物变异性仍不清楚。有时,应用的归一化和简化程度越多,就越难直观地理解一种处理方法如何影响细胞死亡。
Tip7:仔细检查图表标注
细胞死亡数据结果的呈现方式会影响我们对这些结果的解读。细胞死亡分析通常以x-y图的形式呈现,其中y轴是“细胞死亡”的某种测量值。衡量标准可能包括活细胞计数、死细胞计数、群体中检测到的细胞死亡标记物的数量或群体代谢活动。需要特别注意这些不同类型的数据在y轴是如何标注的,尤其是来自不同检测方法的数据被归一化并转换成“细胞死亡百分比”或“细胞存活百分比”值时。如上所述,大量代谢物读数并不直接体现细胞死亡情况,但有时会被作为细胞死亡的衡量标准。同样,仅对细胞死亡或死细胞情况进行定量也不一定能有效说明群体中细胞死亡的总体水平。理想情况下,y轴应标注实际的测量值,以避免数据被过度解读或误读的风险。此外,y轴的范围也很重要,有时y轴不是呈现一个完整的范围(0-100%),而是被限制在一组有限的值之间,这往往会在视觉上放大差异。
Tip8:注意细胞菌株和细胞培养条件
细胞供应源、传代数和生长条件是细胞死亡实验中的重要变量。培养中的细胞在不断变化,这种变化可能导致不同实验室使用的同一细胞系菌株之间细胞死亡的差异[9]。细胞死亡反应也会因生长培养基成分、细胞数量或培养容器中的细胞汇合度不同而存在差异。因此,关注上述变量至关重要。在某些情况下,实验之间、实验室之间的结果差异可以用细胞系克隆漂移、检测细胞融合差异及细胞生长条件来解释[11,12]。虽然细胞死亡数据的报告程序在不断改进,但是存在的变量以及差异并不是一直出现在所公布的方法内。
Tip 9:关注效应量和可重复性
可重复性是生物学研究中的重大难题。即使是相对简单的实验设计,也包含数十个潜在的误差来源,这些误差来源与原材料、试剂、细胞培养和接种条件、移液器校准等有关[13]。即使尽可能使用相同的试剂和实验方案,不同实验室的细胞存活率实验结果仍然会有差异[11]。 重要的是要考虑到,在细胞死亡研究中,实验误差或随机误差可能是造成不同条件下观察到差异的原因。
结果可重复性是避免误差的一道重要防线。在细胞生物学和动物研究中,实验可重复性究竟是什么呢?已发表的研究报告在这一点上并不明确。有些研究认为在多孔板的平行孔中同时进行的实验是“独立”的重复,这种方法节省了时间,但很大限度地降低了生物变异性和系统性产生的风险。有时实验会在不同时间出结果,但只有一个独立实验的数据会作为代表性数据显示出来,这就很难评估其生物变异程度。
细胞和试剂即使来自同一动物或同一批次,在不同时间进行重复实验也会存在类似的潜在混淆风险。因此需谨慎对待规模较小、在独立实验中未重复且仅在一种环境中得到验证的细胞死亡。在一种细胞系中获得的细胞死亡发现是否也能在另一种细胞系中获得,以及独立和正交的方法(如细胞死亡机制特异性标记物的生化读数和活细胞与死细胞成像计数)是否都指向相同的机制结论[14]也是关键问题之一。由两个或更多个独立研究小组得出的类似机制发现其可信度会更高,并且比仅在单个实验室中获得的任何结果更具有普遍性。
Tip 10:仔细评估细胞死亡机制
细胞死亡可以通过细胞凋亡或几种非凋亡细胞死亡机制之一进行,这些机制并不容易区分。研究者有必要关注如何监测不同的细胞死亡机制。细胞死亡机制特异性标志物会报告一种细胞死亡机制的激活情况,但对可能同时发生的其他细胞死亡机制视而不见。我们渐渐深入发现了一些机制特异性细胞死亡标志物。例如,磷脂酰丝氨酸结合Annexin V历来被用作细胞凋亡的标志物,但磷脂酰丝氨酸也可能暴露在经历坏死性凋亡和其他形式的非凋亡细胞死亡的细胞表面[15]。在解释使用机制特异性细胞死亡抑制剂获得的结果时也需要谨慎,这可能会产生脱靶效应。例如一些小分子具有独立于蛋白质结合的隐自由基捕获抗氧化活性,可抑制铁死亡[16]。通过不断完善和更新用于评估细胞死亡机制的标准,有可能更清晰地解释现有数据和新数据。
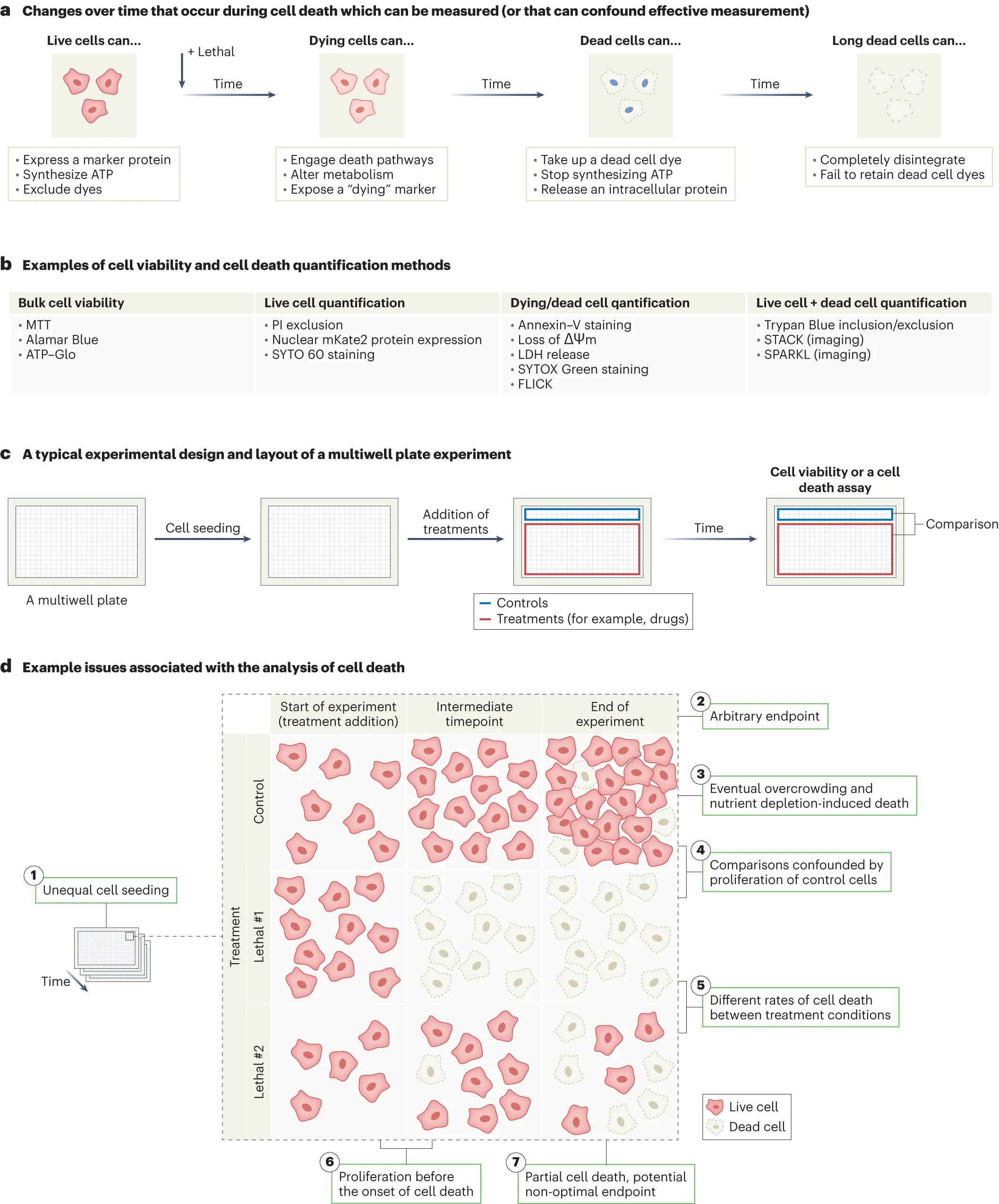
与细胞死亡检测相关的问题概述
a、活细胞、濒死细胞和死细胞可以产生独特的和可测量的信号。b、常见细胞活力和细胞死亡定量方法举例。FLICK,基于荧光和裂解的细胞死亡动力学推断;LDH,乳酸脱氢酶;MTT,3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide;PI,碘化丙啶;SPARKL,使用实时动力学标记的单细胞和群体水平分析;STACK,可扩展的细胞死亡动力学延时分析。 c、多孔板中典型的细胞死亡检测实验设计示例。d、七种不同的变量和因素会影响细胞死亡实验的解释。在使用终点测量法和间接生化检测法(如 ATP 总丰度或四氮唑还原强度)时,这些影响混淆数据解释的可能性尤为严重。
那么有什么样的工具可以有助于细胞死亡检测呢?
奎克泰生物的EVE™和ADAM™系列自动细胞计数仪,操作简单,快速区分活死细胞,计算细胞存活率!
奎克泰生物的JuLI™系列实时活细胞成像分析仪能够放置于培养箱内,对细胞进行实时观察、拍摄记录生长周期的全过程,在保证细胞生长环境稳定的情况下,同时对细胞计数、拍照,形成视频,分析融合度与生长曲线,提供细胞死亡量化结果!

[1]Dixon SJ, Lee MJ. Quick tips for interpreting cell death experiments. Nat Cell Biol. 2023 Dec;25(12):1720-1723.
[2] Chan GK, Kleinheinz TL, Peterson D, Moffat JG. A simple high-content cell cycle assay reveals frequent discrepancies between cell number and ATP and MTS proliferation assays. PLoS One. 2013 May 17;8(5):e63583.
[3] Forcina GC, Conlon M, Wells A, Cao JY, Dixon SJ. Systematic Quantification of Population Cell Death Kinetics in Mammalian Cells. Cell Syst. 2017 Jun 28;4(6):600-610.e6.
[4] Gelles JD, Mohammed JN, Santos LC, Legarda D, Ting AT, Chipuk JE. Single-Cell and Population-Level Analyses Using Real-Time Kinetic Labeling Couples Proliferation and Cell Death Mechanisms. Dev Cell. 2019 Oct 21;51(2):277-291.e4.
[5] Richards R, Schwartz HR, Honeywell ME, Stewart MS, Cruz-Gordillo P, Joyce AJ, Landry BD, Lee MJ. Drug antagonism and single-agent dominance result from differences in death kinetics. Nat Chem Biol. 2020 Jul;16(7):791-800.
[6] Harris LA, Frick PL, Garbett SP, Hardeman KN, Paudel BB, Lopez CF, Quaranta V, Tyson DR. An unbiased metric of antiproliferative drug effect in vitro. Nat Methods. 2016 Jun;13(6):497-500.
[7] Schwartz HR, Richards R, Fontana RE, Joyce AJ, Honeywell ME, Lee MJ. Drug GRADE: An Integrated Analysis of Population Growth and Cell Death Reveals Drug-Specific and Cancer Subtype-Specific Response Profiles. Cell Rep. 2020 Jun 23;31(12):107800.
[8] Hafner M, Mills CE, Subramanian K, Chen C, Chung M, Boswell SA, Everley RA, Liu C, Walmsley CS, Juric D, Sorger PK. Multiomics Profiling Establishes the Polypharmacology of FDA-Approved CDK4/6 Inhibitors and the Potential for Differential Clinical Activity. Cell Chem Biol. 2019 Aug 15;26(8):1067-1080.e8.
[9] Hafner M, Niepel M, Chung M, Sorger PK. Growth rate inhibition metrics correct for confounders in measuring sensitivity to cancer drugs. Nat Methods. 2016 Jun;13(6):521-7.
[10] Ben-David U, Siranosian B, Ha G, Tang H, Oren Y, Hinohara K, Strathdee CA, Dempster J, Lyons NJ, Burns R, Nag A, Kugener G, Cimini B, Tsvetkov P, Maruvka YE, O'Rourke R, Garrity A, Tubelli AA, Bandopadhayay P, Tsherniak A, Vazquez F, Wong B, Birger C, Ghandi M, Thorner AR, Bittker JA, Meyerson M, Getz G, Beroukhim R, Golub TR. Genetic and transcriptional evolution alters cancer cell line drug response. Nature. 2018 Aug;560(7718):325-330.
[11] Elliott JT, Rösslein M, Song NW, Toman B, Kinsner-Ovaskainen A, Maniratanachote R, Salit ML, Petersen EJ, Sequeira F, Romsos EL, Kim SJ, Lee J, von Moos NR, Rossi F, Hirsch C, Krug HF, Suchaoin W, Wick P. Toward achieving harmonization in a nano-cytotoxicity assay measurement through an interlaboratory comparison study. ALTEX. 2017;34(2):201-218.
[12] Haverty PM, Lin E, Tan J, Yu Y, Lam B, Lianoglou S, Neve RM, Martin S, Settleman J, Yauch RL, Bourgon R. Reproducible pharmacogenomic profiling of cancer cell line panels. Nature. 2016 May 19;533(7603):333-7.
[13] Rösslein M, Elliott JT, Salit M, Petersen EJ, Hirsch C, Krug HF, Wick P. Use of Cause-and-Effect Analysis to Design a High-Quality Nanocytotoxicology Assay. Chem Res Toxicol. 2015 Jan 20;28(1):21-30.
[14] Vaux DL. Research methods: Know when your numbers are significant. Nature. 2012 Dec 13;492(7428):180-1.
[15] Gong YN, Guy C, Olauson H, Becker JU, Yang M, Fitzgerald P, Linkermann A, Green DR. ESCRT-III Acts Downstream of MLKL to Regulate Necroptotic Cell Death and Its Consequences. Cell. 2017 Apr 6;169(2):286-300.e16.
[16] Shah R, Shchepinov MS, Pratt DA. Resolving the Role of Lipoxygenases in the Initiation and Execution of Ferroptosis. ACS Cent Sci. 2018 Mar 28;4(3):387-396.

