SMI技术揭示Repeat RNA在人体胰腺癌中扰乱细胞可塑性
2024-10-15 来源:本站 点击次数:1118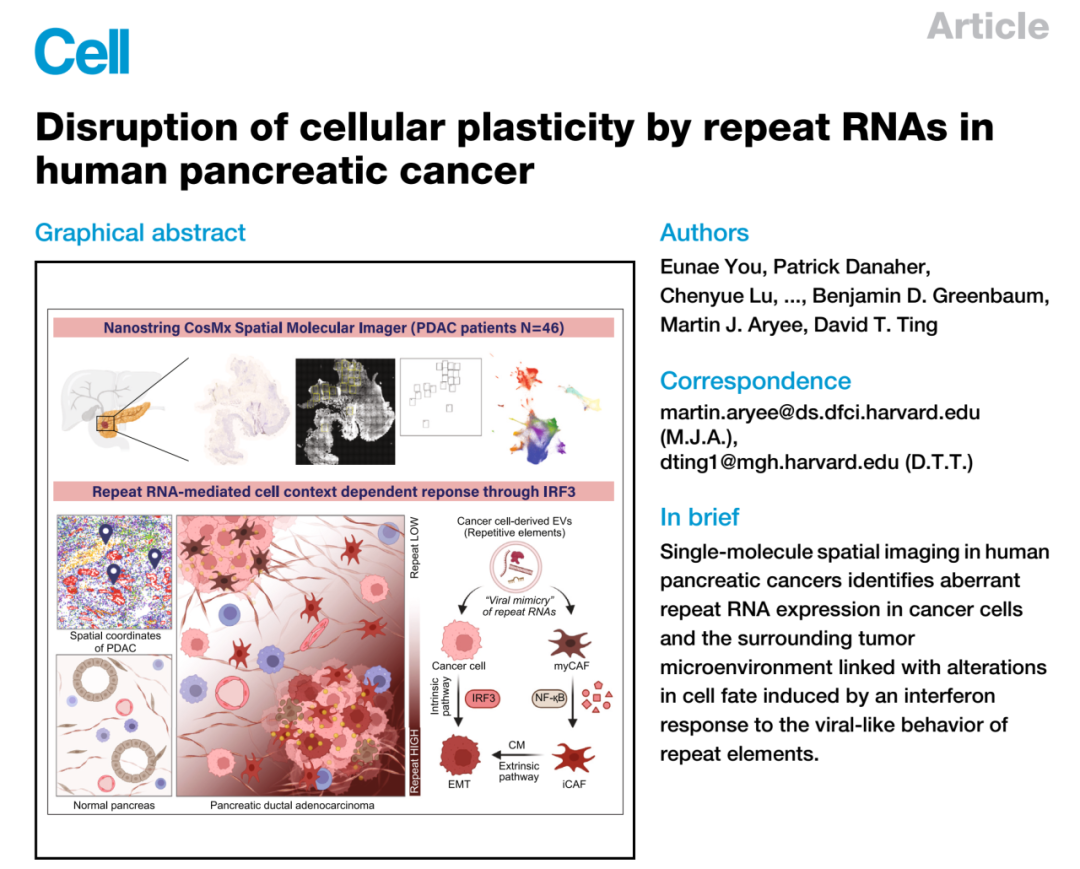
题目:Repeat RNA在人体胰腺癌中扰乱细胞可塑性
期刊:Cell
IF:45.5
文章背景
胰腺导管腺癌(PDAC)是一种致命的癌症,具有显著的肿瘤内异质性。Repeat RNA是由基因组中大量重复序列转录而来的RNA。基因组中有许多重复的非编码区域,这些区域可以分为不同的类别,如卫星重复序列(如HSATII)、长散在核元件(LINE-1)和内源性逆转录病毒(HERV)等。Repeat RNA通常来源于这些重复序列的转录活动,尽管它们在过去被认为是“基因组噪音”或无功能的部分,近年来它们被发现可能在多种生物学过程中发挥作用,尤其在疾病背景下。
技术平台
文章使用NanoString CosMx SMI单细胞空间分子成像平台,揭示了胰腺癌细胞及其周围微环境中的repeat RNA表达及特征。研究使用了来自46名PDAC患者的组织样本,具体包括三例固定的石蜡包埋组织(FFPE)和四个组织芯片(TMA),结合自定义的repeat RNA探针和1000种RNA panel,覆盖了多种细胞类型。
文章研究思路
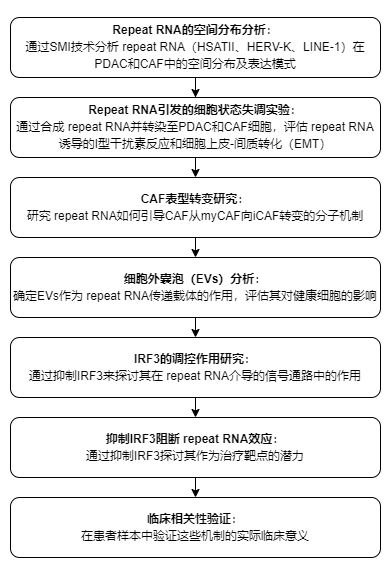
文章结论
1. 多种repeat RNA在PDAC肿瘤细胞和周围微环境中的空间分布
使用SMI单细胞空间分子成像平台揭示了repeat RNA和编码RNA在胰腺癌细胞及其微环境中的分布情况。采用UMAP降维分析展示不同细胞类型的聚类,包括癌细胞、成纤维细胞、免疫细胞等多种细胞类型。细胞类型的空间定位表明PDAC的肿瘤微环境具有高度异质性。测量不同细胞类型的repeat RNA的平均表达水平发现癌细胞的repeat RNA表达最高,特别是LINE-1、HSATII、HERV-K和HERV-H等,其他细胞类型(如成纤维细胞和免疫细胞)虽然也有repeat RNA表达,但水平较低。
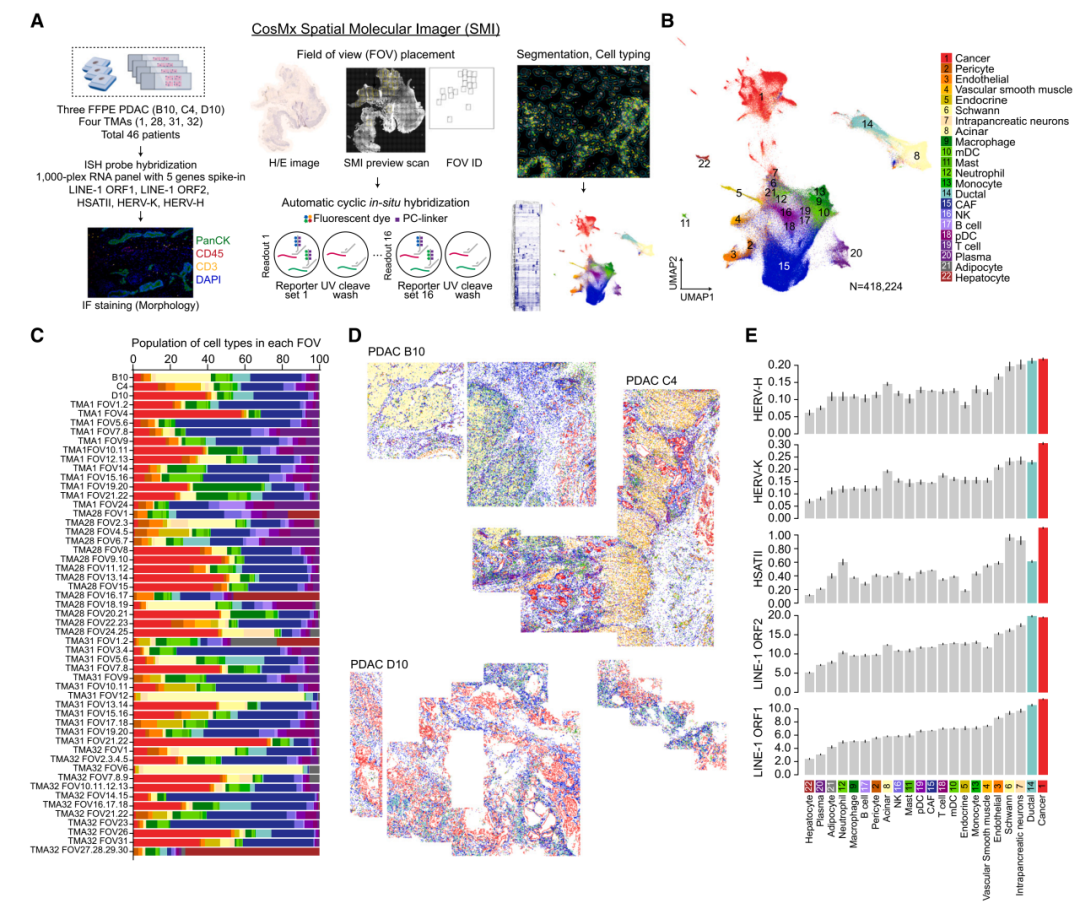
对 PDAC TME 不同细胞类型中repeat RNA表达谱的空间转录组分析
2. Repeat RNA表达对癌细胞和CAF的影响
将癌细胞按照LINE-1 ORF1(repeat RNA)表达水平分为高表达组和低表达组,进行差异基因表达分析。高LINE-1 ORF1表达的癌细胞表现出角蛋白(KRT)基因表达下降、炎症基因(如IFNAR2、IL10)表达增加,呈现出去上皮化和增强的炎症反应。CAF、巨噬细胞、内皮细胞等类型中,repeat RNA的高表达也与炎症基因上调相关,表明其不仅影响癌细胞,也显著改变肿瘤微环境。进一步分析发现,CAF的基因表达与其距离癌细胞的远近高度相关,特别是在距离癌细胞20-50微米范围内表现出最强效应。Repeat RNA的持续正效应表明其可能通过细胞间传递影响CAF的状态。COL3A1基因主要在CAF细胞中高表达,而在癌细胞中几乎不可检测。相反,repeat RNA的表达在CAF和癌细胞中均较高,这表明repeat RNA可能通过PDAC细胞向CAF传递。
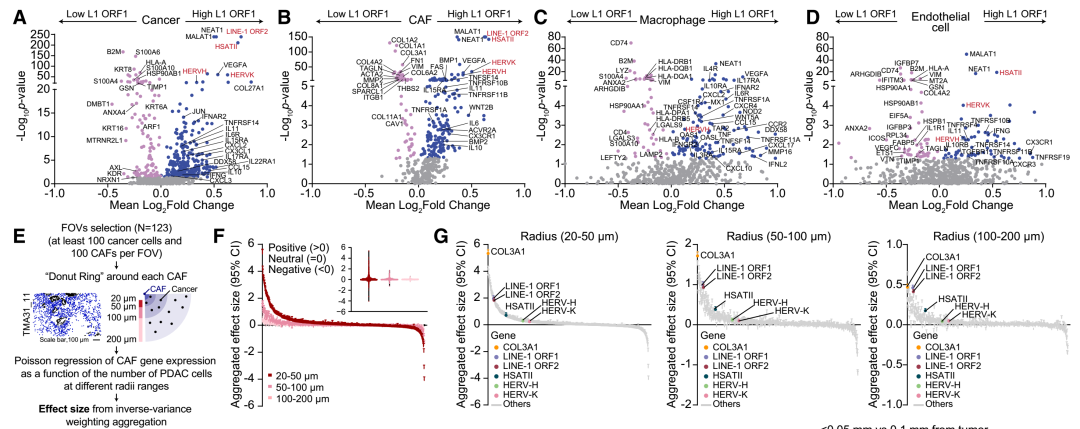
高LINE-1 ORF1表达对癌细胞和CAF的影响
3. Repeat RNA调控CAF亚型转变及其空间分布
COL3A1基因在CAF细胞中高表达,特别是在myCAF中,而LINE-1 ORF1在iCAF和混合状态的CAF中较高,表明repeat RNA在CAF由myCAF向iCAF转变过程中起到调控作用。myCAF基因在靠近癌细胞时呈现正效应,而iCAF基因则呈负效应。myCAF和iCAF在距离癌细胞较近时,LINE-1 ORF1表达更高,暗示其表达可能由癌细胞诱导。在靠近癌细胞的区域,myCAF的LINE-1 ORF1表达显著降低,表明CAF的状态发生了转变。
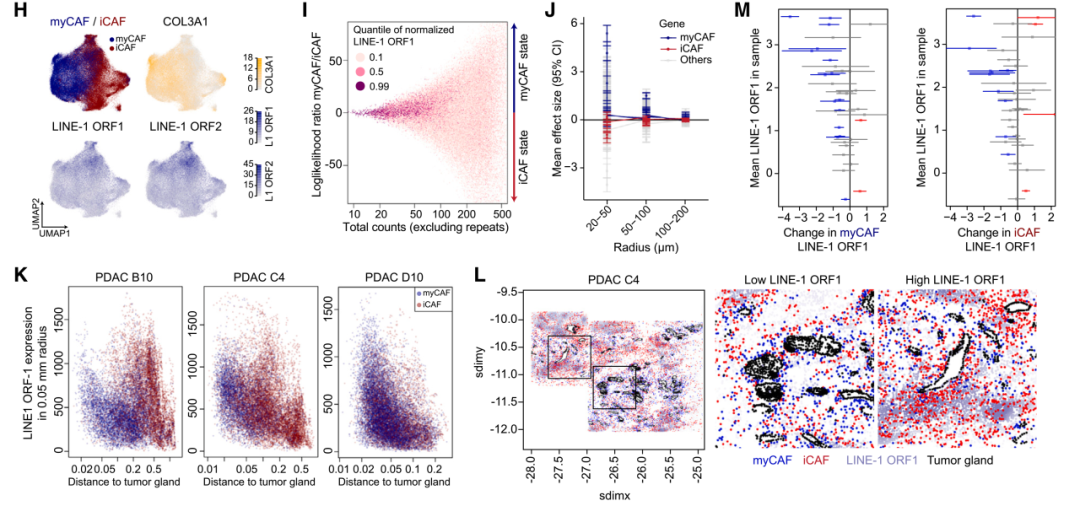
多种repeat RNA影响CAFs中的细胞可塑性反应
4. 含有repeat RNA的细胞外囊泡(EVs)会引起PDAC和CAF状态的失调
PDAC来源的EVs富含多种repeat RNA,包括HSATII、HERV-K和LINE-1。这些EVs被转移到CAF和PDAC细胞后,激活了I型干扰素反应,引发了强烈的炎症反应。EVs的传递还导致CAF表型发生显著转变,myCAF逐渐转变为炎症性CAF(iCAF),表现为myCAF基因(ACTA2、TAGLN)表达减少,而iCAF基因(IL6、IL11)的表达显著增加。同时,PDAC细胞也经历了由上皮状态向间质状态的转变。进一步研究通过使用抗体阻断EV摄取,显著抑制I型干扰素和iCAF标志基因的表达,并恢复myCAF基因的表达,证明EV是repeat RNA在细胞间传递的主要载体。此外,CAF暴露于PDAC来源的EV后会分泌更多的EV,这些EV可能进一步传递repeat RNA,影响PDAC细胞的上皮-间质转化,形成细胞间的正反馈环路。
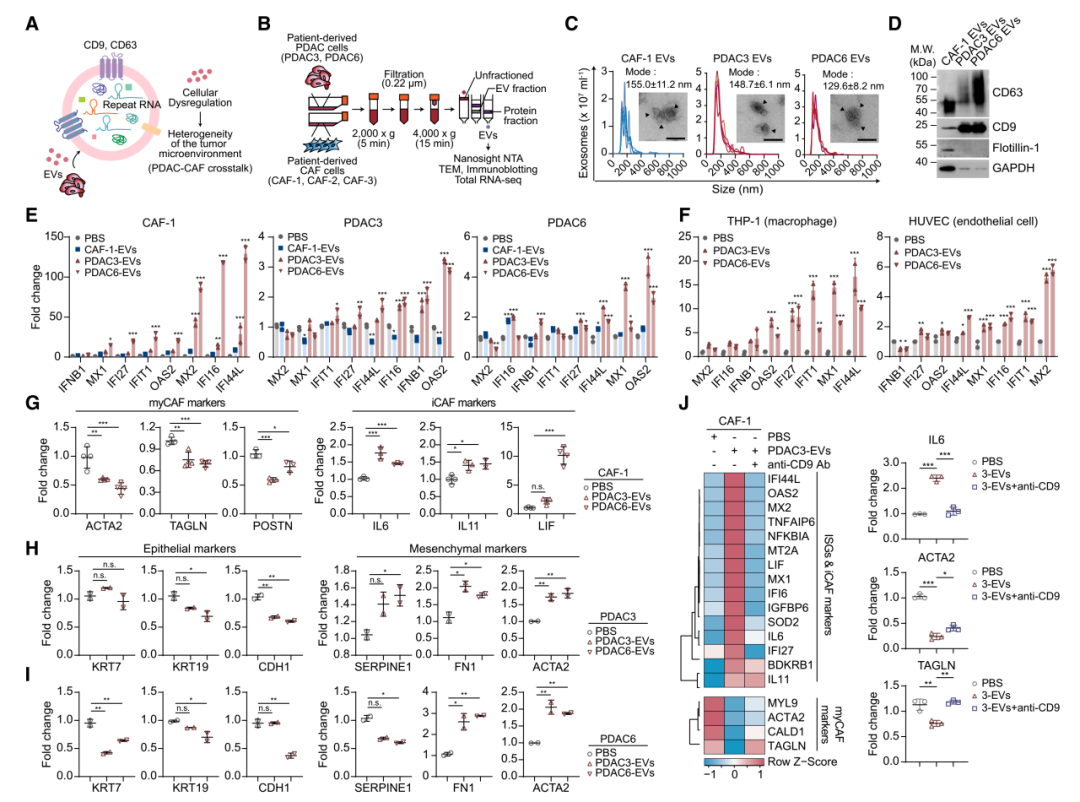
EVs在PDAC和CAF细胞之间传递repeat RNA
5. Repeat RNA在胰腺癌微环境中通过调控CAF和PDAC促进细胞状态变化的重要机制
Repeat RNA通过直接作用于CAF促使其表型转变。转染HSATII和HERV-K repeat RNA至PDAC细胞后,观察到I型干扰素和EMT相关基因的显著变化,表明repeat RNA能够促进PDAC细胞的EMT,从而推动癌细胞的侵袭性和异质性。IRF3作为repeat RNA诱导的I型干扰素反应的核心调控因子,在PDAC细胞和CAF中激活后,分别促进了细胞的EMT和CAF表型转变。IRF3的抑制导致了repeat RNA诱导的这些状态变化的显著减少。Repeat RNA通过细胞外囊泡介导细胞间信号传递,含有repeat RNA的EVs能够在PDAC微环境中通过转递信号诱导健康胰腺细胞发生EMT,进一步增强了肿瘤的侵袭性。
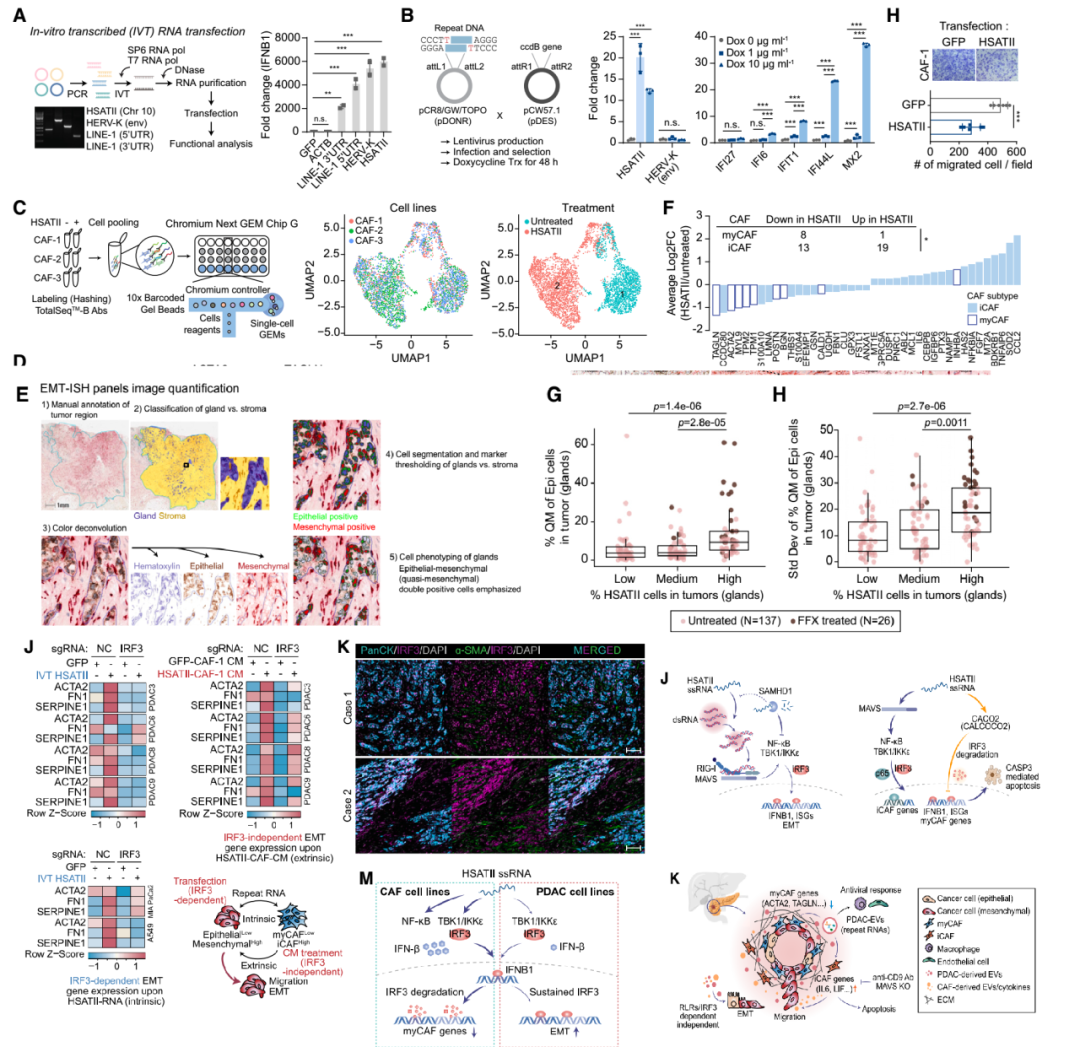
Repeat RNA在癌症发展中的关键作用
总结
这篇文章通过SMI单细胞空间转录组技术揭示了repeat RNA在PDAC中的重要作用,阐明了其如何通过干扰素反应影响癌细胞和肿瘤微环境中的其他细胞。研究发现,repeat RNA在癌细胞和CAF中高度表达,促使细胞状态发生显著变化,特别是推动癌细胞发生上皮-间质转化(EMT)和CAF从成肌纤维表型(myCAF)向炎症性表型(iCAF)转变。细胞外囊泡EVs被确认是repeat RNA在细胞间传递的关键载体,进一步加剧了细胞状态的失调。通过抑制IRF3等关键信号分子,研究证明了repeat RNA驱动的干扰素反应在PDAC中的核心调控作用。此外,实验表明repeat RNA在健康细胞中也能引发EMT,推动肿瘤的扩散和侵袭性。整体而言,该研究揭示了repeat RNA在胰腺癌中的致病机制,为PDAC的治疗提供了新的治疗靶点和潜在的干预策略。

