单细胞多组学在胶质母细胞瘤异质性分析中的应用
2025-03-10 来源:本站 点击次数:362编者按:
单细胞多组学技术以很高的精度和深度,彻底改变我们对复杂疾病的理解。整合单个细胞的染色质可及性、转录和翻译水平,可揭示传统方法无法捕捉的细胞异质性和分子机制。新研究利用单细胞核RNA测序和ATAC测序,深入剖析了胶质母细胞瘤(GBM)的内部结构,发现了关键转录因子AP-1和BACH1在细胞状态转换中的重要作用,不仅揭示了GBM的高度异质性,还为个性化治疗提供了坚实基础。
研究背景
胶质母细胞瘤(GBM)是一种高度恶性的脑肿瘤,患者预后极差,中位生存期不足15个月。为了开发更有效的治疗方法,研究人员利用单细胞核RNA测序和单细胞ATAC测序,分析了配对的GBM患者样本,构建了详细的细胞类型图谱,揭示了GBM内部的高度异质性和不同细胞类型的基因表达模式。总体而言,本研究为理解GBM的细胞异质性和分子机制提供了新视角,并为个性化治疗策略奠定了基础。
文章详情
文章题目:Single-cell multi-omics sequencing uncovers region-specific plasticity of glioblastoma for complementary therapeutic targeting
中文题目:单细胞多组学测序揭示胶质母细胞瘤的区域特异的可塑性及其互补治疗靶标
发表时间:2024.11
期刊名称:Science Advances
影响因子:11.7
实验平台:单细胞核转录组测序+ATAC测序
DOI:10.1126/sciadv.adn4306
研究结果
1、配对GBM患者组织的单细胞多组学谱型
为了揭示胶质母细胞瘤(GBM)的异质性,研究人员利用单细胞RNA测序(snRNA-seq)和单细胞ATAC测序(snATAC-seq),分析了配对的GBM患者样本。通过整合这两种技术,研究团队构建了详细的细胞类型图谱,展示了不同细胞类型的基因表达和染色质可及性特征。这项工作为个性化医疗提供了新的视角,揭示了GBM内部的高度异质性。
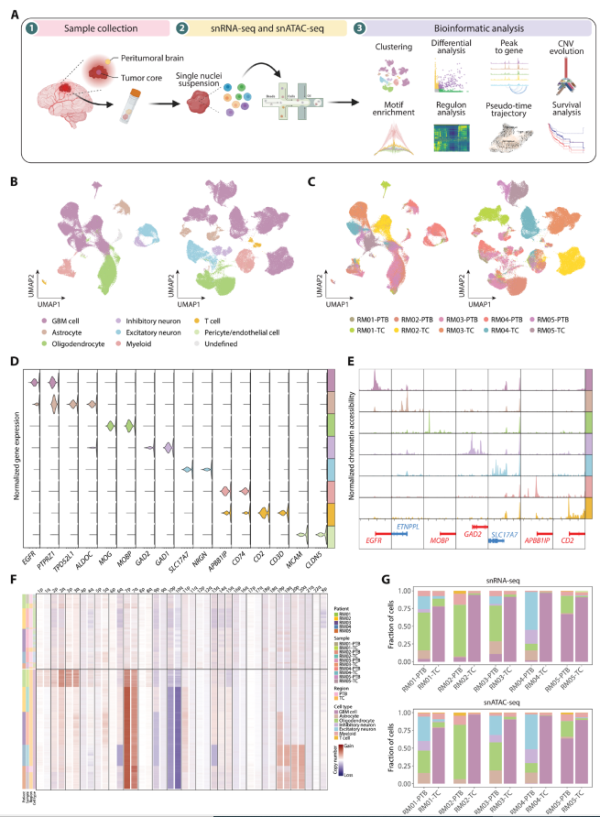 Fig1. GBM基因表达和染色质可及性的单细胞图谱
Fig1. GBM基因表达和染色质可及性的单细胞图谱
2、细胞类型特异性调控GBM中的染色质可及性
研究人员结合snRNA-seq和snATAC-seq,鉴定了52,485个具有高度细胞类型特异性的基因相关顺式调控元件(gl-CREs)。该研究揭示了9042个CRE链接的基因,每个基因平均连接到5个CREs,强调了远端调控元件在调控细胞类型特异性基因表达中的重要作用。这些发现为探索新型治疗靶点提供了理论基础。
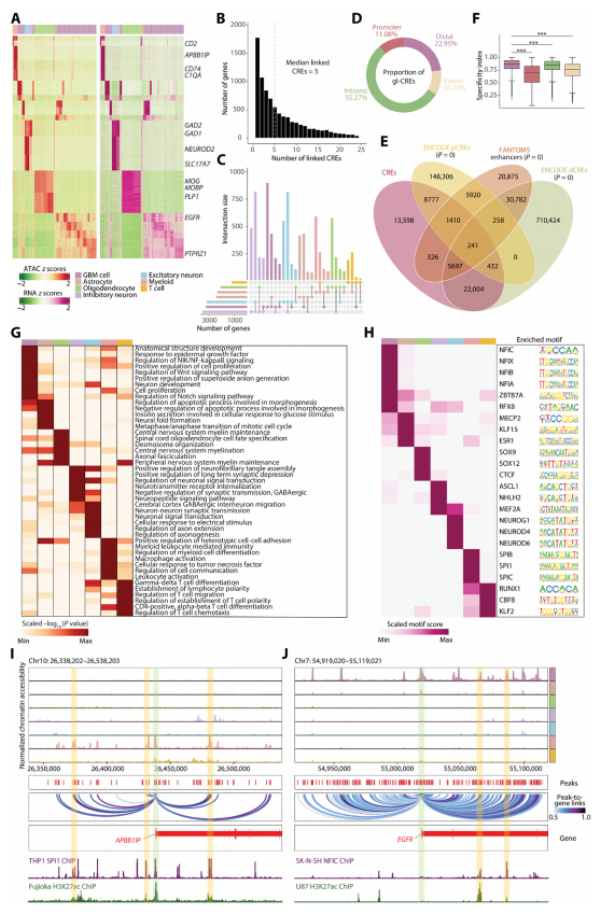 Fig2. 远端峰赋予细胞类型特异性并揭示潜在的细胞类型特异性TF调节
Fig2. 远端峰赋予细胞类型特异性并揭示潜在的细胞类型特异性TF调节
3、浸润至周边脑组织的恶性细胞具有独特的转录组特征
研究人员使用inferCNV和Uphyloplot2分析GBM细胞的基因组结构,发现浸润至周边脑组织(PTB)的GBM细胞表现出较弱的泛癌特征,并在代谢和增殖方面不活跃。进一步的转录组分析显示,PTB中的细胞诱导了与神经元发育相关的基因,表明健康脑区域的微环境对其有显著影响。
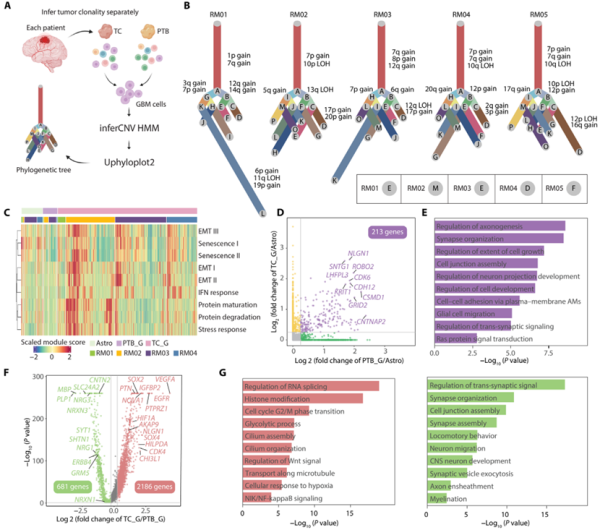 Fig3. 浸润的GBM细胞与TC中的GBM细胞相比具有不同的特征
Fig3. 浸润的GBM细胞与TC中的GBM细胞相比具有不同的特征
4、多样化的转录因子驱动GBM细胞状态
本部分探讨了GBM细胞状态的高度可塑性和多样性,发现了患者间及同一患者内肿瘤核心区(TC)和PTB区域间的显著异质性。OPC-like细胞在PTB中比例增加,而AC-like细胞减少。研究鉴定出数十种状态特异性转录因子(TFs),如GFI1、FOXK1等,提示AP-1可能是关键因素,但其活性在不同状态下有所变化,需要谨慎考虑作为治疗靶点。
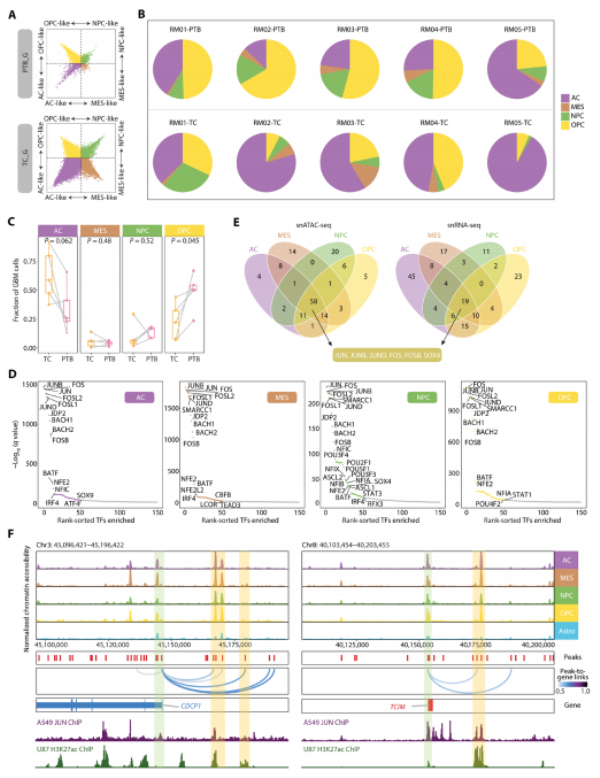 Fig4. 四种细胞状态下的GBM细胞共享调控子AP-1
Fig4. 四种细胞状态下的GBM细胞共享调控子AP-1
5、PTB区域中AP-1活性下降而BACH1活性增加
研究人员在单细胞水平上比较了PTB_G和TC_G中AP-1的活性,发现AP-1在TC_G中活跃但在PTB_G中显著下降,具有区域性异质性。与此同时,BACH1在PTB_G中的调控网络活性高于TC_G。研究揭示了BACH1增强子在PTB_G中的更高活性,提示其表达上调可能由远端增强子调控,提出了AP-1和BACH1在GBM细胞中可能存在互补关系。
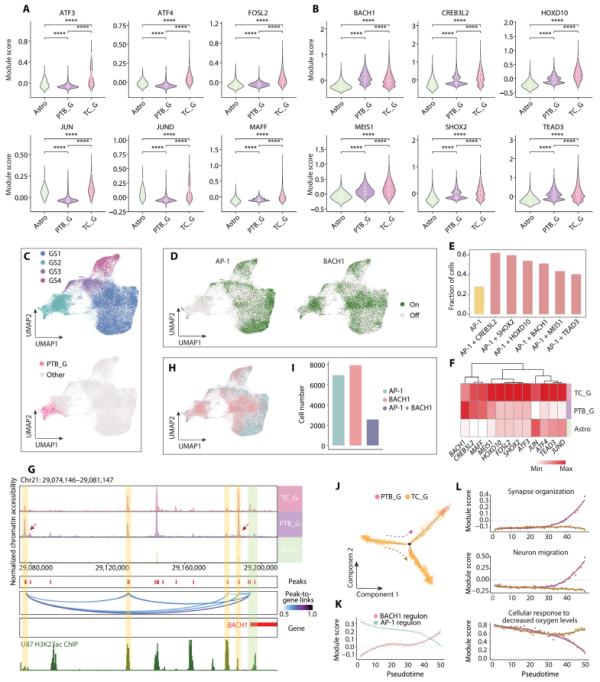 Fig5. PTB中GBM细胞的调控改变
Fig5. PTB中GBM细胞的调控改变
6、GBM细胞侵袭过程中的动态转录组调控
研究人员构建了伪时间轨迹,推断GBM细胞在浸润时如何改变其转录组。结果显示,随着轨迹的发展,AP-1活性从起点急剧下降,而BACH1逐渐增加。GO分析揭示了沿PTB分支上调基因的功能,包括微管基运动、神经元迁移等。相反,下调基因涉及缺氧反应、双链断裂修复等。这些结果表明,伴随AP-1活性下降和BACH1增加,浸润细胞获得了更多神经元样的迁移能力,同时减少了缺氧应激和细胞死亡。
7、靶向AP-1和BACH1的联合疗法
研究人员测试了双重靶点抑制(AP-1和BACH1)是否能产生协同肿瘤抑制效果。体外实验显示,GBM细胞系U251经shRNA介导的BACH1敲低和ERK1/2抑制剂ulixertinib处理后,比单独治疗更有效地抑制细胞增殖和迁移。体内实验也证实,联合治疗显著改善了肿瘤控制并延长了生存期。FDA批准的小分子药物hemin用于实现BACH1降解,同样展示了良好的治疗效果。这些数据显示了双重靶点疗法在体外和体内对GBM的有效性,值得进一步评估。
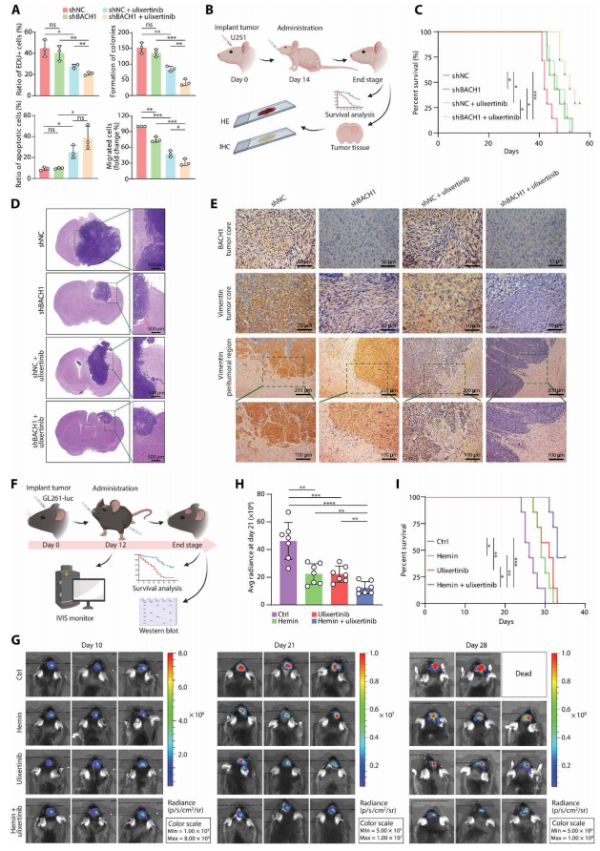 Fig6. 联合疗法可抑制GBM小鼠模型中的肿瘤生长并提高生存率
Fig6. 联合疗法可抑制GBM小鼠模型中的肿瘤生长并提高生存率
主要结论
本研究收集了来自肿瘤核心(TC)和周边脑组织(PTB)的配对样本,进行snRNA-seq和snATAC-seq分析。结果显示,从肿瘤核心浸润到周边脑组织的肿瘤细胞在转录组水平上更类似于少突胶质细胞前体细胞而非星形胶质细胞。肿瘤基因组中的远端调控区域及特定转录因子可能是区域异质性的潜在决定因素。值得注意的是,激活蛋白1(AP-1)在所有GBM状态下均活跃,但其活性从肿瘤核心到周边脑组织逐渐下降,而另一个转录因子BACH1则表现出相反的趋势。联合抑制AP-1和BACH1比单一靶向治疗更能有效减缓小鼠模型中的肿瘤进展并延长生存期。综上所述,我们的研究揭示了浸润GBM细胞显著的分子改变,并证明了针对肿瘤内部及其远端区域异质性的联合治疗具有协同效应。
参考文献:
Wang, Xin et al. “Single-cell multi-omics sequencing uncovers region-specific plasticity of glioblastoma for complementary therapeutic targeting.” Science advances vol. 10,47 (2024): eadn4306.

