Emulate器官芯片助力研究药物引起肝损伤的机制
2025-04-09 来源:本站 点击次数:311肝器官芯片同时支持多种肝实质/非实质细胞生长,通过微流控系统驱动培养基的连续灌注,能够确保这些细胞维持正常的生长、代谢以及在其他因素刺激后呈现应有的反应状态,从而达到模拟肝脏微小结构单元的生理或病理状态。目前,肝芯片应用的场景较为广泛,例如毒性测试、药物安全性测试、对特定疾病建模、研究疾病病理机制等。下面我们分享肝芯片和药物引起肝损伤的两篇文章。
一、肝脏芯片可在各物种中预测候选药物的毒性
新药研发流程进入临床试验前,会在非啮齿动物模型中评估其安全性。目前,非啮齿动物模型的毒理实验能够正确预测71% 毒性,其中在胃肠道、血液学和心血管毒性的预测中表现出相对较高的一致性,但在预测药物性肝损伤 (DILI)的表现中并不理想。
本文中作者使用肝芯片容纳源自非啮齿动物(大鼠、狗)和人的不同类型的肝细胞—肝实质细胞、内皮细胞、星状细胞和库普弗细胞,构建了具有功能的体外肝脏单元,从而实现跨物种检测多种药物对肝脏的特异性作用。
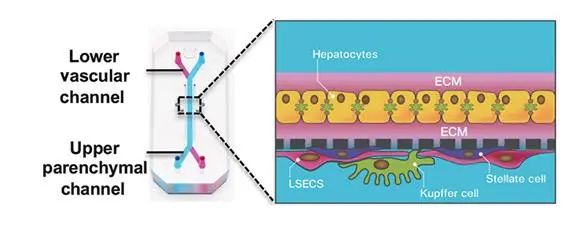 图1 肝细胞结构的肝芯片示意图
图1 肝细胞结构的肝芯片示意图注:原代肝细胞以ECM三明治形式在上实质通道中生长,NPC(LSEC、Kupffer 和星状细胞)生长在下血管通道中同一膜的另一侧
例如,研究发现波生坦(一种被批准用于治疗肺动脉高压的药物)可导致人类胆汁淤积,但不会引起大鼠或狗的胆汁淤积。每天施用不同浓度的波生坦会导致物种特异性芯片中的白蛋白分泌减少,这一效应在人、狗和大鼠芯片中具有不同的体现,其中,波生坦施加在人肝芯片上的效果与临床反应的相关性最强,其在人肝芯片上的毒性浓度和出现DILI的患者血浆浓度近似。
接下来进行的实验表明,将因导致大鼠肝毒性而停产的杨森专有化合物JNJ-2在大鼠芯片中测试,连续每日施用JNJ-2(150mg/kg),持续2周会导致芯片上表现出肝纤维化的现象。但相比之下,用相同浓度连续处理人肝芯片4天不会影响肝细胞正常功能,延长处理时间至14天,也不会产生这些异常,这说明大鼠和人肝细胞对JNJ-2的反应具有物种差异。
最后,该平台测试一种名叫TAK-875的候选药物的特异性毒性作用,该药物会导致线粒体功能障碍、氧化应激、脂滴形成和先天免疫反应(细胞因子释放)等副作用。实验结果表明,在部分肝芯片测试中发生了例如在一项24周的TAK-875临床试验中,7名转氨酶高的患者中有5名的肝活检出现脂肪变性。通过在肝芯片中用药测试后发现,继发于线粒体功能障碍和活性氧形成的脂肪性肝炎可能是TAK-875治疗后DILI的潜在表型。这项试验体现了肝脏芯片在评估反应性代谢物形成的病理生理学后果方面的优势,可在药物测试过程中更好地了解候选药物的副作用。
二、评估人类肝脏芯片在药性肝损伤方面的应用
本文评估了肝器官芯片再现肝脏代谢和毒理学表型的能力。与2D静态培养物相比,它们允许在更长的时间内维持与在体肝细胞一致的表型。肝器官芯片在检测DILI化合物方面显示出增强的代谢和毒理学表型,具有更高的灵敏度和特异性。
以具有肝毒性的乙酰氨基酚(APAP)为例,已知对APAP最敏感的生物标志物是肝脏芯片中的白蛋白。通过监测,APAP对肝芯片给药后1天可观察到白蛋白分泌减少,在第10天时白蛋白的分泌和细胞活力值并没有随着药物剂量的升高而出现理想中的线性结果,即剂量依赖性降低。对APAP的代谢物做定量后发现,药物治疗时谷胱甘肽(GSH)会自发地通过谷胱甘肽-S-转移酶与APAP发生酶促反应以形成APAP谷胱甘肽结合物( APAP-GSH),肝脏芯片中代谢物的清除率增强可能会导致 APAP-GSH的低水平。此外,作者还对FIAU进行测定。这是一种具有抗病毒活性的核苷类似物,肝脏中对其敏感的生物标志物为白蛋白和miR-122。在肝芯片中给药至第7天和第10天时观察到剂量和时间依赖性减少,在第10天还出现了细胞活力的剂量依赖性降低,并且miR-122的释放增加了1至5倍。
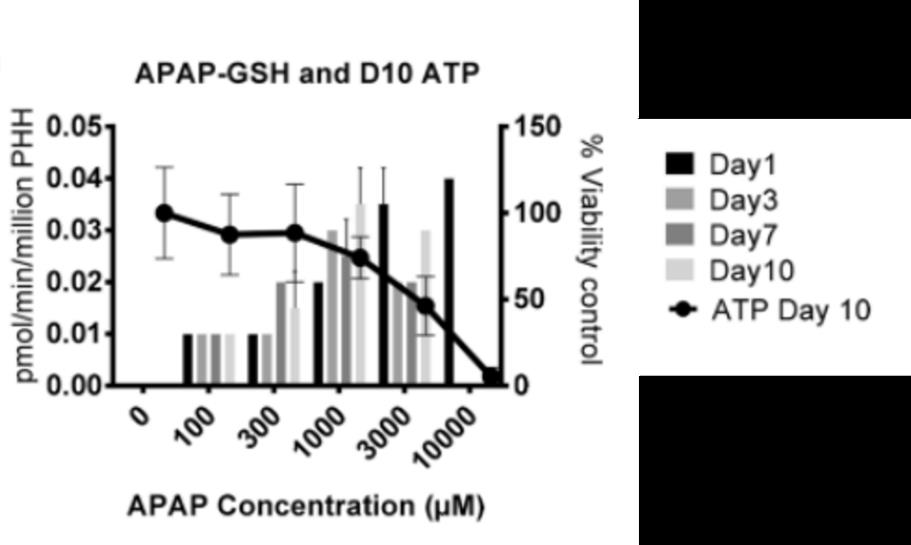 图2 APAP 肝芯片中的APAP-GSH代谢物形成率
图2 APAP 肝芯片中的APAP-GSH代谢物形成率注:在第0-1、2-3、6-7和9-10天收集肝芯片肝细胞通道样品,用于通过LC-MS测定APAP-GSH代谢物。第10天的细胞活力由 ATP 耗竭决定,并且该谱覆盖在代谢谱上。
由此,该实验证明了这一体外模型在功能性药物代谢以及细胞应激和细胞毒性生物标志物的释放相关的指标与临床数据大致相似,因此肝芯片可作为更好的评估药物安全的体外实验模型。
参考文献:
1.Jang, K. J., Otieno, M. A., Ronxhi, J., Lim, H. K., Ewart, L., Kodella, K. R., Petropolis, D. B., Kulkarni, G., Rubins, J. E., Conegliano, D., Nawroth, J., Simic, D., Lam, W., Singer, M., Barale, E., Singh, B., Sonee, M., Streeter, A. J., Manthey, C., Jones, B., … Hamilton, G. A. (2019). Reproducing human and cross-species drug toxicities using a Liver-Chip. Science translational medicine, 11(517), eaax5516.
2. Foster, A. J., Chouhan, B., Regan, S. L., Rollison, H., Amberntsson, S., Andersson, L. C., Srivastava, A., Darnell, M., Cairns, J., Lazic, S. E., Jang, K. J., Petropolis, D. B., Kodella, K., Rubins, J. E., Williams, D., Hamilton, G. A., Ewart, L., & Morgan, P. (2019). Integrated in vitro models for hepatic safety and metabolism: evaluation of a human Liver-Chip and liver spheroid. Archives of toxicology, 93(4), 1021–1037.

