空间多组学技术揭示肺癌微环境的空间基因表达
2025-03-10 来源:本站 点击次数:374编者按:
空间多组学技术正革新肿瘤研究,以很高的分辨率揭示组织内部基因表达模式。本研究利用多种空间转录组技术平台,深入解析了肺腺癌中肿瘤细胞与微环境的互动,涵盖早期病变至侵袭性癌症。该技术不仅发现了早期免疫反应的存在,还揭示了肿瘤进展中的关键变化,为精准医疗提供了宝贵数据。空间多组学技术这一革命性工具,将开启肺癌研究新篇章。
研究背景
非小细胞肺癌(NSCLC)是肺癌中最常见的类型,其中肺腺癌(LUAD)尤为普遍。肿瘤微环境(TME)复杂多样,影响肿瘤的发生、发展及治疗反应。借助空间转录组学和单细胞测序技术,研究人员能够高分辨率解析肿瘤内部及其周围组织的基因表达模式。本研究中,借助空间多组学技术,研究者探讨了不同突变特征的LUAD病例中肿瘤细胞与微环境的相互作用,评估肿瘤细胞与其周围细胞的关系,并通过单细胞水平验证分析揭示TME特征。此外,研究团队调查了早期LUAD及肿瘤进展早期阶段的TME状态,解析免疫细胞在早期肿瘤微环境中的行为及其对肿瘤细胞命运的影响。这些发现为理解早期癌症发展机制提供了新视角,并为早期诊断和个性化治疗策略奠定了基础。
文章详情
文章题目:Spatially resolved gene expression profiling of tumor microenvironment reveals key steps of lung adenocarcinoma development
中文题目:肿瘤微环境的空间基因表达谱揭示肺癌腺癌发展的关键步骤
发表时间:2024.12
期刊名称:Nature Communications
影响因子:14.7
实验平台:10x Genomics Xenium+10x visium空间转录组测序
DOI:10.1038/s41467-024-54671-7
研究结果
1、研究设计概述
为了系统地理解肺癌微环境(TME)的复杂性和多样性,研究团队采用了空间转录组学技术和单细胞分辨率分析方法。通过整合Visium空间转录组数据与Xenium原位基因表达分析,研究人员旨在揭示肿瘤细胞与其微环境之间的相互作用机制。此外,该研究还特别关注早期肺腺癌(如AISs和MIAs)以及侵袭性腺癌(IA)病例中的TME变化,以探索肿瘤进展的不同阶段特征。
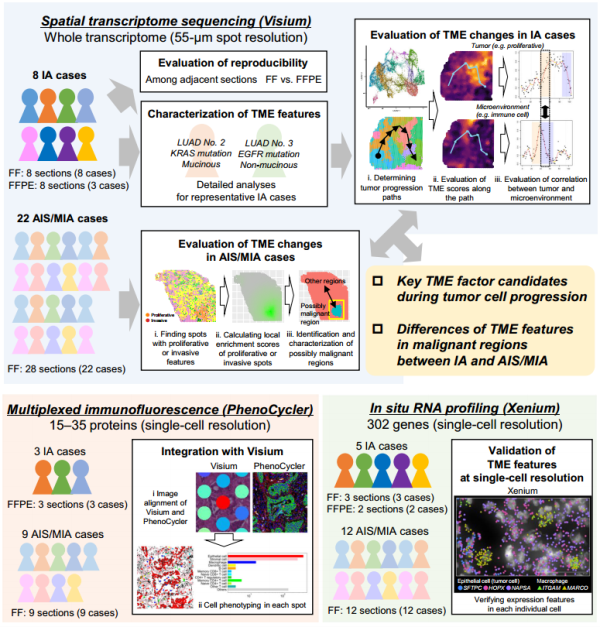 Fig1. 研究概述
Fig1. 研究概述
2、空间表达模式与微环境多样性
为了深入理解不同类型肺癌中肿瘤细胞的空间分布及其与微环境的相互作用,研究团队分析了LUAD No. 2(KRAS突变,黏液性癌症)和LUAD No. 3(EGFR突变,非黏液性癌症)的空间表达模式。通过空间转录组学技术,研究人员发现LUAD No. 2表现出显著的空间异质性,尤其是在肿瘤细胞与基质细胞、免疫细胞之间的互动方面。这类癌症内部存在复杂的基因表达特征,揭示了其独特的生物学行为。对于LUAD No. 3,研究揭示了其内部多样化的微环境状态,包括不同类型的免疫细胞和成纤维细胞,解释了为何某些EGFR突变型肺癌对治疗反应各异,并为个性化医疗策略提供了理论依据。在同一组织切片内,LUAD No. 3展示了高度多样化的微环境状态,不同区域内肿瘤细胞与微环境成分(如CAFs和免疫细胞)之间存在显著差异,特别是在未分化或侵袭性癌细胞簇的存在上,这表明肿瘤细胞可能发展出控制与基质细胞互动的能力,以排除免疫细胞攻击。这些发现共同揭示了不同类型肺癌中肿瘤细胞如何适应并改变其微环境,从而促进自身生长和发展。
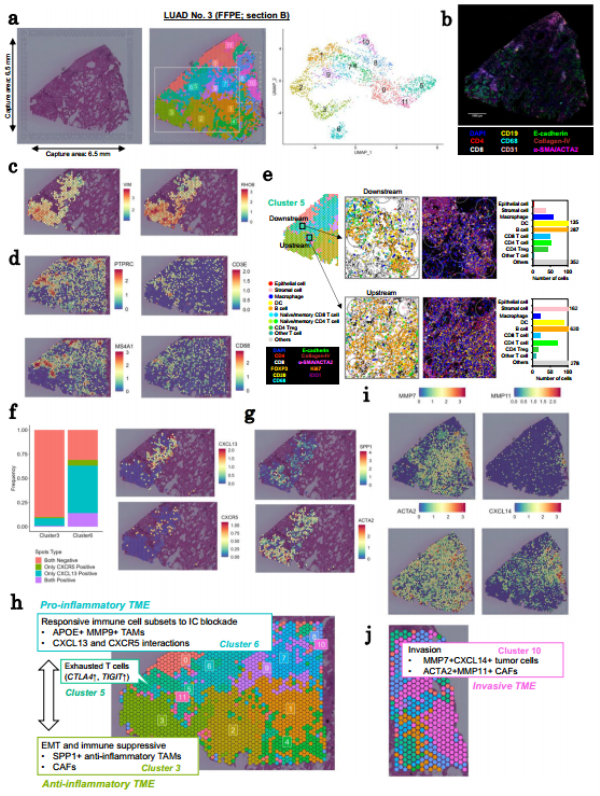 Fig2. LUAD No.3局部转变为侵袭性表型
Fig2. LUAD No.3局部转变为侵袭性表型
3、侵袭性腺癌(IA)病例中肿瘤细胞及其周围细胞的跨病例或切片评分
为了从更广泛的角度概括具有空间特征的基因表达谱及其相互关联,研究人员采用了PAGE分析等方法,将选定基因的空间表达模式转换为活性评分,从而对多个IA病例进行了系统性比较。通过这种方法,研究团队能够一致地比较不同标本之间特定状态区域宽度,并识别出恶性特征与CAF谱型的正相关以及侵袭特征与免疫细胞的负相关。这些结果为理解IA病例中肿瘤细胞与其微环境的关系提供了新的视角。
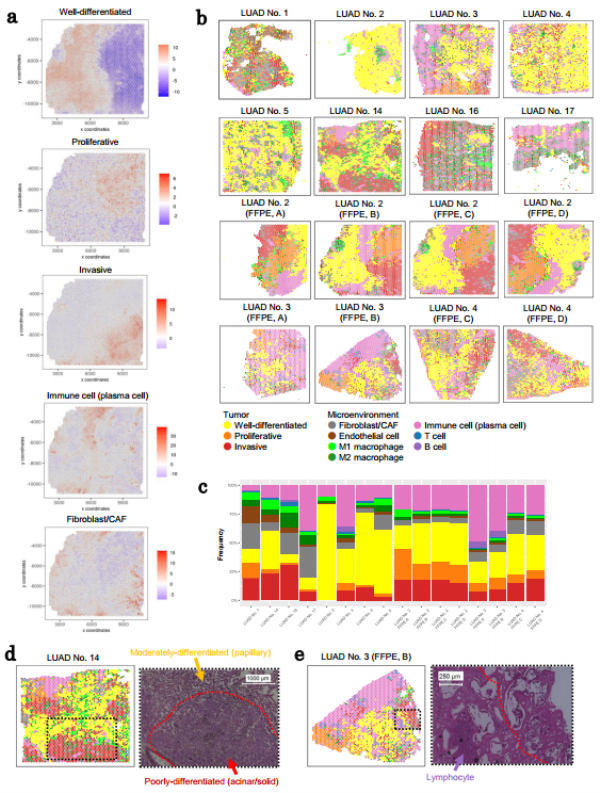 Fig3. 不同病例或切片的TME局部表达特征评
Fig3. 不同病例或切片的TME局部表达特征评
4、TME在单细胞水平上的验证分析
为了验证上述发现并在单细胞水平上进一步解析TME特征,研究团队使用Xenium技术对五个标本进行了原位基因表达分析。通过单细胞分辨率的数据,研究人员不仅确认了之前的发现,还揭示了肿瘤细胞内部NKX2-1到HNF4A阳性转变等新特征。此外,CCL22阳性和IDO1表达细胞的存在表明,即使在免疫抑制环境中,某些CD8+ T细胞仍保持细胞毒性活性。这一部分的研究强调了单细胞分析在揭示肿瘤微环境复杂性方面的价值
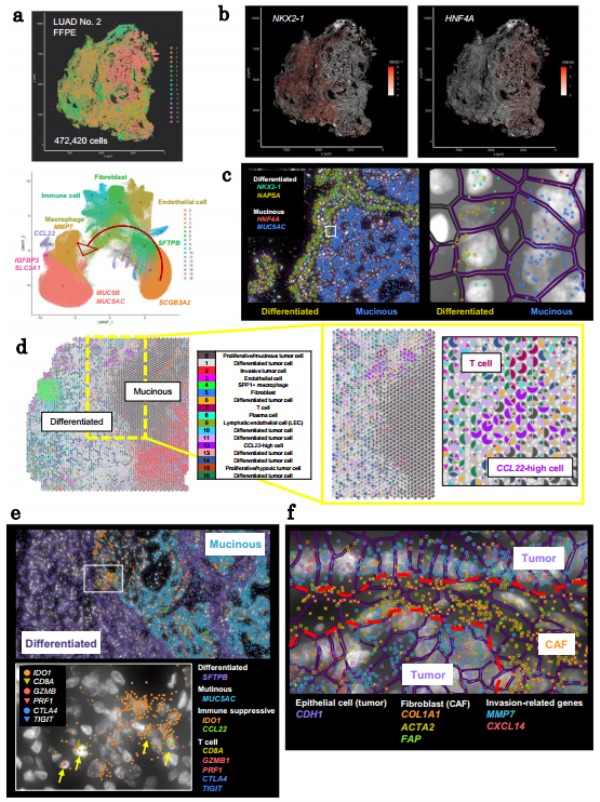 Fig4. LUAD No.2中TME的空间和单细胞表征
Fig4. LUAD No.2中TME的空间和单细胞表征
5、早期肺腺癌中的TME演变及免疫细胞互动
研究团队进一步探讨了极早期的肺腺癌(如AISs和MIAs)以及肿瘤进展早期阶段的TME状态变化。尽管大多数早期肿瘤表现为“分化良好”,但免疫细胞区域并未显著减少,表明免疫反应已在早期发生。相比之下,“恶性”区域较小且分布稀疏,暗示着早期肿瘤尚未完全激活所有促癌通路。通过对这些早期病变的详细分析,研究人员发现了一些核心基因表达变化已经开始向IA转变的证据,为早期诊断和干预提供了理论支持。此外,研究团队深入探讨了肿瘤发展的更早阶段是否已经存在显著的微环境变化。通过精细解析早期肿瘤微环境中免疫细胞的行为,他们发现炎症淋巴细胞和巨噬细胞在“可能恶性”区域中更为活跃。特别是在TSU-33中,高水平的CCL19表达和B细胞浸润提示了强烈的免疫反应。这些发现表明,即便是在早期肿瘤中,免疫细胞与肿瘤细胞之间的互动也起着关键作用,决定了癌症细胞的命运。FABP4+和SPP1+巨噬细胞的共定位进一步证实了这一点,显示了肿瘤细胞如何试图突破免疫屏障以实现扩张。这些结果强调了早期TME状态对肿瘤进展的重要影响,为理解早期癌症的发展机制提供了新的视角。
 Fig5. 极早期病例的TME表征
Fig5. 极早期病例的TME表征
主要结论
本研究展示了来自30名非侵袭性和侵袭性阶段的肺癌腺癌患者的高分辨率空间转录组图谱。结合空间转录组测序数据与原位RNA谱型分析,研究者对每个病例进行详细的检查。基于观察到的多样化谱型及其后续计算分析揭示,肿瘤细胞表型的显著变化通常伴随着免疫细胞特征的变化。这一现象与一系列细胞表达程序的诱导相吻合,这些程序使肿瘤细胞能够转化并突破免疫细胞屏障,并继续发展。这些结果揭示了肺癌如何通过与其微环境的相互作用而发展。
> 参考文献:
Takano, Yuma et al. “Spatially resolved gene expression profiling of tumor microenvironment reveals key steps of lung adenocarcinoma development.” Nature communications vol. 15,1 10637. 6 Dec. 202

