PLX5622抑制剂的作用机制及在神经退行性疾病中的应用
2025-09-12 来源:本站 点击次数:38
PLX5622 作为一种高选择性的集落刺激因子1受体(CSF1R)抑制剂,在科研领域尤其是涉及中枢神经系统(CNS)的研究中备受关注。PLX5622(AbMole,M9512)能够通过阻断 CSF1R 信号传导,实现对中枢神经系统(CNS)中的小胶质细胞的特异性耗竭。AbMole为全球科研客户提供高纯度、高生物活性的抑制剂、细胞因子、人源单抗、天然产物、荧光染料、多肽、靶点蛋白、化合物库、抗生素等科研试剂,全球大量文献专利引用。
一、PLX5622的作用机制
小胶质细胞作为中枢神经系统中主要的固有免疫细胞,在大脑稳态、神经发育、免疫防御以及神经退行性疾病进程等诸多方面发挥着关键作用。CSF1R 属于受体酪氨酸激酶家族,在小胶质细胞的发育、存活和功能调控中扮演着核心角色。在正常生理状态下,CSF1R与其配体集落刺激因子 1(CSF1)或白细胞介素 34(IL-34)结合后,受体发生二聚化并自磷酸化,进而激活下游一系列信号转导通路,如 PI3K/AKT、RAS/RAF/MEK/ERK 等[1]。这些信号与小胶质细胞(Microglia)的增殖高度相关[1]。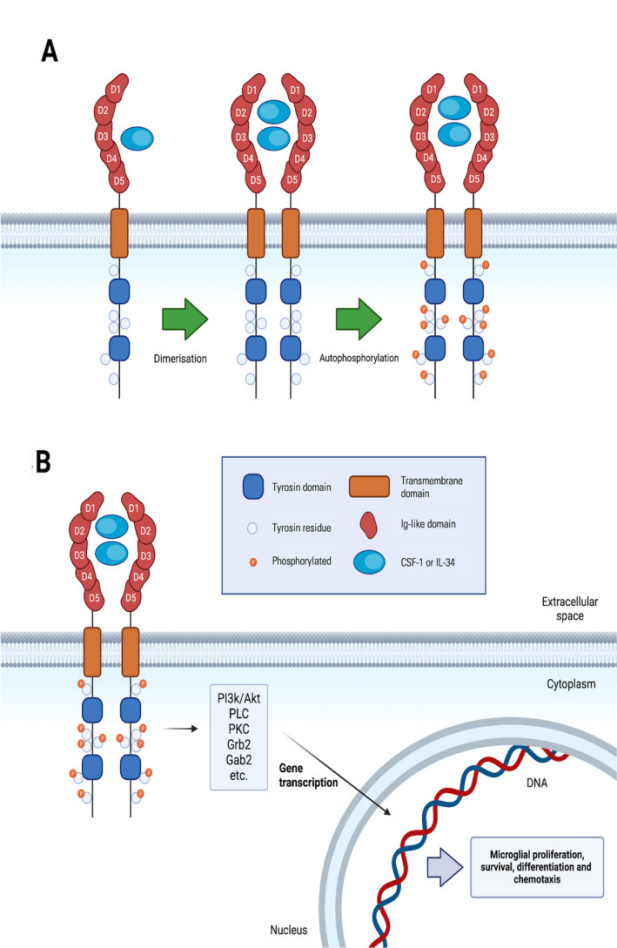


二、PLX5622的科研应用
1. PLX5622用于小胶质细胞耗竭
小胶质细胞在中枢神经系统的免疫中扮演着重要角色,它们参与大脑的先天性和获得性免疫反应,并清除病原体、细胞碎片和凋亡细胞,维持大脑的稳态。小胶质细胞具有多种表型,包括促炎的M1型和抗炎的M2型,其在哺乳动物的多种神经系统疾病中扮演重要角色,例如阿尔兹海默症、帕金森等。PLX5622(AbMole,M9512)可在细胞、类器官和动物层面的实验中抑制CSF1R,诱导小胶质细胞耗竭。例如PLX5622可用于处理大鼠器官型脑切片与胶质母细胞瘤 (GBM) 共培养物(OBSC),发现PLX5622的加入可促进GBM肿瘤球的增长,其背后的机制是PLX5622耗竭了小胶质细胞(Microglia)的增殖,减少了后者对GBM肿瘤细胞的吞噬[4]。在动物实验中,可以混入动物饲料的方式,使小鼠获取PLX5622。例如按照1200 mg/kg (PLX5622/AIN76A大鼠小鼠标准化饲料)的比例,喂养C57 BL/6J小鼠,在一周后,PLX5622可以显著减少小胶质细胞的数量,耗竭效率可达95%以上。并且这种耗竭状态可以持续数月[5]。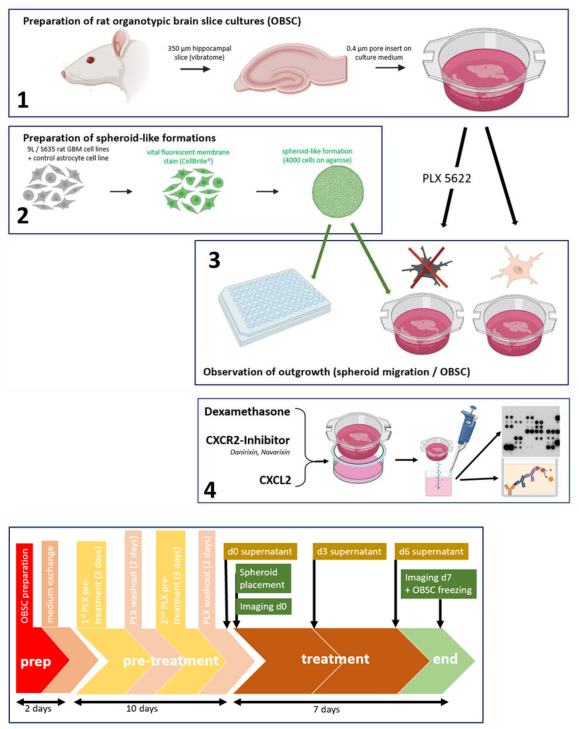

PLX5622(AbMole,M9512)在动物退行性神经疾病模型的研究中具有重要的应用价值。以Alzheimer’s Disease(AD)为例,AD伴随着β-淀粉样蛋白(Aβ)斑块沉积、tau蛋白过度磷酸化,以及神经元丢失等多种复杂变化。小胶质细胞在AD形成的过程中具有双重作用,它负责清理β-淀粉样蛋白,但持续的炎症刺激会导致小胶质细胞过度激活,分泌大量促炎细胞因子,加重神经炎症反应,促进疾病进展。在5xFAD(家族性阿尔茨海默病模型,俗称5转)小鼠中,从1.5月龄开始持续喂养含有PLX5622的饲料(1200 mg/kg),在喂养2.5月后,结果显示小胶质细胞几乎完全被耗竭(97%至100%),且这种耗竭效果可持续24周。此外,研究还发现,PLX5622处理后,5xFAD小鼠的Aβ沉积显著减少[6]。
3. PLX5622用于脑损伤与脊髓损伤模型的研究
在动物发生脑损伤和脊髓损伤后,会引发一系列复杂的病理生理反应,其中神经炎症是导致继发性损伤的重要因素之一,而小胶质细胞在神经炎症反应中处于核心地位。在创伤性脑损伤(TBI)模型中,受损后的小胶质细胞迅速被激活,释放大量促炎细胞因子,如白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)和 TNF-α 等,这些细胞因子会进一步加重炎症反应,导致神经元死亡和神经功能障碍。使用PLX5622 耗竭TBI模型小鼠(成年雄性C57Bl/6J小鼠)中的小胶质细胞后,小鼠脑组织表现出更少的炎症反应,同时行为学测试要显著优于对照组[7]。在另一项以PLX5622作为CSF1R抑制剂的研究中,使用成年C57BL/6J小鼠进行脊髓压迫损伤(T10水平)以构建Spinal cord injury (SCI) 模型,在损伤前14天开始喂食含有1200mg/kg PLX562的饲料,并持续到损伤后的第28天,研究发现PLX5622处理后,脊髓中小胶质细胞数量显著减少,这有助于减少前期恢复过程的炎症反应[8]。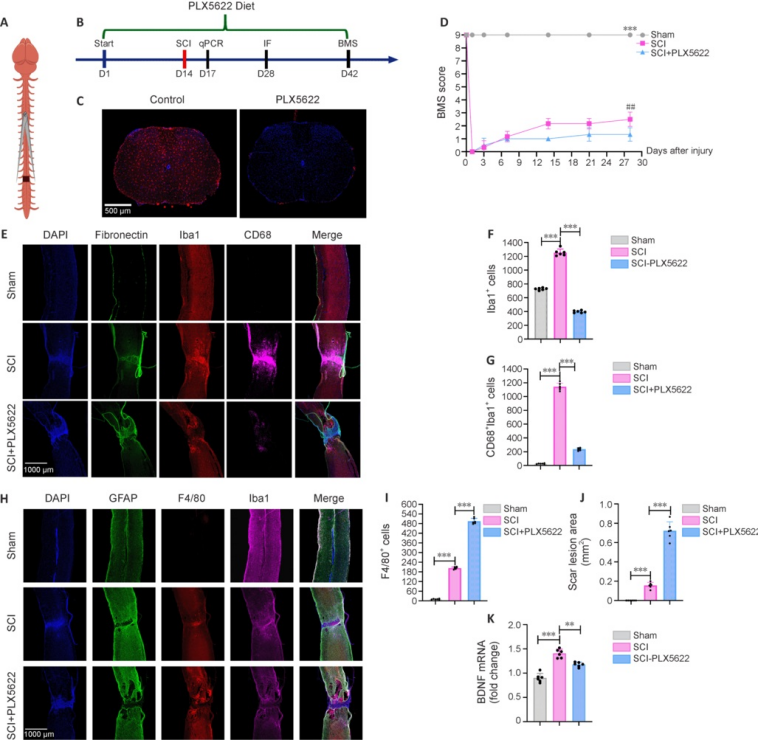

AbMole是ChemBridge中国区官方指定合作伙伴。


参考文献及鸣谢
[1] D. Guenoun, N. Blaise, A. Sellam, et al., Microglial Depletion, a New Tool in Neuroinflammatory Disorders: Comparison of Pharmacological Inhibitors of the CSF-1R, Glia 73(4) (2025) 686-700.
[2] E. Spangenberg, P. L. Severson, L. A. Hohsfield, et al., Sustained microglial depletion with CSF1R inhibitor impairs parenchymal plaque development in an Alzheimer's disease model, Nat Commun 10(1) (2019) 3758.
[3] X. Yang, L. Zhao, M. M. Campos, et al., CSF1R blockade induces macrophage ablation and results in mouse choroidal vascular atrophy and RPE disorganization, eLife 9 (2020).
[4] J. Falter, A. Lohmeier, P. Eberl, et al., CXCR2-Blocking Has Context-Sensitive Effects on Rat Glioblastoma Cell Line Outgrowth (S635) in an Organotypic Rat Brain Slice Culture Depending on Microglia-Depletion (PLX5622) and Dexamethasone Treatment, International journal of molecular sciences 24(23) (2023).
[5] F. Zeng, Y. Li, X. Li, et al., Microglia overexpressing brain-derived neurotrophic factor promote vascular repair and functional recovery in mice after spinal cord injury, Neural regeneration research 21(1) (2026) 365-376.
[6] C. Romero-Molina, V. Navarro, S. Jimenez, et al., Should We Open Fire on Microglia? Depletion Models as Tools to Elucidate Microglial Role in Health and Alzheimer's Disease, International journal of molecular sciences 22(18) (2021).
[7] Rebecca J. Henry, David J. Loane, Targeting chronic and evolving neuroinflammation following traumatic brain injury to improve long-term outcomes: insights from microglial-depletion models, 16(5) (2021) 976-977.
[8] Fanzhuo Zeng, Yuxin Li, Xiaoyu Li, et al., Microglia overexpressing brain-derived neurotrophic factor promote vascular repair and functional recovery in mice after spinal cord injury, 21(1) (2026) 365-376.
一、PLX5622的作用机制
小胶质细胞作为中枢神经系统中主要的固有免疫细胞,在大脑稳态、神经发育、免疫防御以及神经退行性疾病进程等诸多方面发挥着关键作用。CSF1R 属于受体酪氨酸激酶家族,在小胶质细胞的发育、存活和功能调控中扮演着核心角色。在正常生理状态下,CSF1R与其配体集落刺激因子 1(CSF1)或白细胞介素 34(IL-34)结合后,受体发生二聚化并自磷酸化,进而激活下游一系列信号转导通路,如 PI3K/AKT、RAS/RAF/MEK/ERK 等[1]。这些信号与小胶质细胞(Microglia)的增殖高度相关[1]。


图 1. CSF1 或 IL-4 激活 CSF1-R 导致小胶质细胞增殖、存活、分化和趋化性[1]
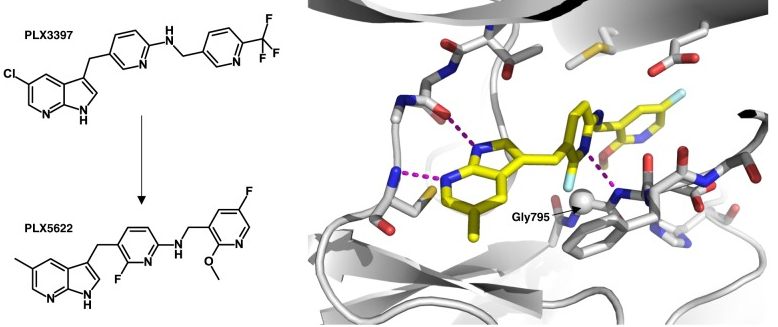
PLX5622(AbMole,M9512)可与CSF1R的Gly-795及其附近的位点结合。一旦PLX5622占据该位点,CSF1R便无法完成结构变化。这一抑制作用导致 CSF1R 无法对下游底物进行磷酸化修饰,使得相关信号通路的传导被有效阻断,最终影响小胶质细胞的存活和功能。研究表明,PLX5622 对CSF1R的抑制作用具有高度的选择性和高效性,其半抑制浓度(IC50)约为0.0016 μM[2],且对CSF1R的选择性比对KIT和FLT3等CSF1R同源激酶高20倍以上[2, 3]。此外,PLX5622还具有血脑屏障透过性,使其非常适用于耗竭各种动物模型中的小胶质细胞,探究小胶质细胞在神经免疫、退行性神经病变中的作用[2]。2014年,AbMole的两款抑制剂分别被西班牙国家心血管研究中心和美国哥伦比亚大学用于动物体内实验,相关科研成果发表于顶刊 Nature 和 Nature Medicine。


图 2. PLX5622 的化学结构及其对CSF1R的抑制[2]
二、PLX5622的科研应用
1. PLX5622用于小胶质细胞耗竭
小胶质细胞在中枢神经系统的免疫中扮演着重要角色,它们参与大脑的先天性和获得性免疫反应,并清除病原体、细胞碎片和凋亡细胞,维持大脑的稳态。小胶质细胞具有多种表型,包括促炎的M1型和抗炎的M2型,其在哺乳动物的多种神经系统疾病中扮演重要角色,例如阿尔兹海默症、帕金森等。PLX5622(AbMole,M9512)可在细胞、类器官和动物层面的实验中抑制CSF1R,诱导小胶质细胞耗竭。例如PLX5622可用于处理大鼠器官型脑切片与胶质母细胞瘤 (GBM) 共培养物(OBSC),发现PLX5622的加入可促进GBM肿瘤球的增长,其背后的机制是PLX5622耗竭了小胶质细胞(Microglia)的增殖,减少了后者对GBM肿瘤细胞的吞噬[4]。在动物实验中,可以混入动物饲料的方式,使小鼠获取PLX5622。例如按照1200 mg/kg (PLX5622/AIN76A大鼠小鼠标准化饲料)的比例,喂养C57 BL/6J小鼠,在一周后,PLX5622可以显著减少小胶质细胞的数量,耗竭效率可达95%以上。并且这种耗竭状态可以持续数月[5]。


图 3. PLX5622用于离体大鼠脑组织切片中小胶质细胞的耗竭[4]
2. PLX5622用于神经退行性疾病模型的研究PLX5622(AbMole,M9512)在动物退行性神经疾病模型的研究中具有重要的应用价值。以Alzheimer’s Disease(AD)为例,AD伴随着β-淀粉样蛋白(Aβ)斑块沉积、tau蛋白过度磷酸化,以及神经元丢失等多种复杂变化。小胶质细胞在AD形成的过程中具有双重作用,它负责清理β-淀粉样蛋白,但持续的炎症刺激会导致小胶质细胞过度激活,分泌大量促炎细胞因子,加重神经炎症反应,促进疾病进展。在5xFAD(家族性阿尔茨海默病模型,俗称5转)小鼠中,从1.5月龄开始持续喂养含有PLX5622的饲料(1200 mg/kg),在喂养2.5月后,结果显示小胶质细胞几乎完全被耗竭(97%至100%),且这种耗竭效果可持续24周。此外,研究还发现,PLX5622处理后,5xFAD小鼠的Aβ沉积显著减少[6]。
3. PLX5622用于脑损伤与脊髓损伤模型的研究
在动物发生脑损伤和脊髓损伤后,会引发一系列复杂的病理生理反应,其中神经炎症是导致继发性损伤的重要因素之一,而小胶质细胞在神经炎症反应中处于核心地位。在创伤性脑损伤(TBI)模型中,受损后的小胶质细胞迅速被激活,释放大量促炎细胞因子,如白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)和 TNF-α 等,这些细胞因子会进一步加重炎症反应,导致神经元死亡和神经功能障碍。使用PLX5622 耗竭TBI模型小鼠(成年雄性C57Bl/6J小鼠)中的小胶质细胞后,小鼠脑组织表现出更少的炎症反应,同时行为学测试要显著优于对照组[7]。在另一项以PLX5622作为CSF1R抑制剂的研究中,使用成年C57BL/6J小鼠进行脊髓压迫损伤(T10水平)以构建Spinal cord injury (SCI) 模型,在损伤前14天开始喂食含有1200mg/kg PLX562的饲料,并持续到损伤后的第28天,研究发现PLX5622处理后,脊髓中小胶质细胞数量显著减少,这有助于减少前期恢复过程的炎症反应[8]。


图 4. Microglia are essential for recovery from spinal cord injury, and their removal is detrimental to recovery from spinal cord injury[8]
AbMole是ChemBridge中国区官方指定合作伙伴。


参考文献及鸣谢
[1] D. Guenoun, N. Blaise, A. Sellam, et al., Microglial Depletion, a New Tool in Neuroinflammatory Disorders: Comparison of Pharmacological Inhibitors of the CSF-1R, Glia 73(4) (2025) 686-700.
[2] E. Spangenberg, P. L. Severson, L. A. Hohsfield, et al., Sustained microglial depletion with CSF1R inhibitor impairs parenchymal plaque development in an Alzheimer's disease model, Nat Commun 10(1) (2019) 3758.
[3] X. Yang, L. Zhao, M. M. Campos, et al., CSF1R blockade induces macrophage ablation and results in mouse choroidal vascular atrophy and RPE disorganization, eLife 9 (2020).
[4] J. Falter, A. Lohmeier, P. Eberl, et al., CXCR2-Blocking Has Context-Sensitive Effects on Rat Glioblastoma Cell Line Outgrowth (S635) in an Organotypic Rat Brain Slice Culture Depending on Microglia-Depletion (PLX5622) and Dexamethasone Treatment, International journal of molecular sciences 24(23) (2023).
[5] F. Zeng, Y. Li, X. Li, et al., Microglia overexpressing brain-derived neurotrophic factor promote vascular repair and functional recovery in mice after spinal cord injury, Neural regeneration research 21(1) (2026) 365-376.
[6] C. Romero-Molina, V. Navarro, S. Jimenez, et al., Should We Open Fire on Microglia? Depletion Models as Tools to Elucidate Microglial Role in Health and Alzheimer's Disease, International journal of molecular sciences 22(18) (2021).
[7] Rebecca J. Henry, David J. Loane, Targeting chronic and evolving neuroinflammation following traumatic brain injury to improve long-term outcomes: insights from microglial-depletion models, 16(5) (2021) 976-977.
[8] Fanzhuo Zeng, Yuxin Li, Xiaoyu Li, et al., Microglia overexpressing brain-derived neurotrophic factor promote vascular repair and functional recovery in mice after spinal cord injury, 21(1) (2026) 365-376.
相关文章
更多 >

