L-Buthionine-sulfoximine(L-BSO)的作用机制及在铁死亡研究中的应用
2025-09-12 来源:本站 点击次数:54
谷胱甘肽(GSH)在细胞内扮演着极为重要的角色,在维持细胞内氧化还原稳态、解毒过程、氨基酸转运等方面发挥着关键作用。细胞内 GSH 的水平受到严格的生物合成调控,L-Buthionine-sulfoximine(L-BSO,AbMole,M3865)作为一种高效且特异性的γ-谷氨酰半胱氨酸合成酶(γ-GCS)抑制剂,能够有效阻断GSH的生物合成途径,并诱导细胞发生铁死亡(Ferroptosis)。AbMole为全球科研客户提供高纯度、高生物活性的抑制剂、细胞因子、人源单抗、天然产物、荧光染料、多肽、靶点蛋白、化合物库、抗生素等科研试剂,全球大量文献专利引用。
一、L-Buthionine-sulfoximine(L-BSO)的作用机制
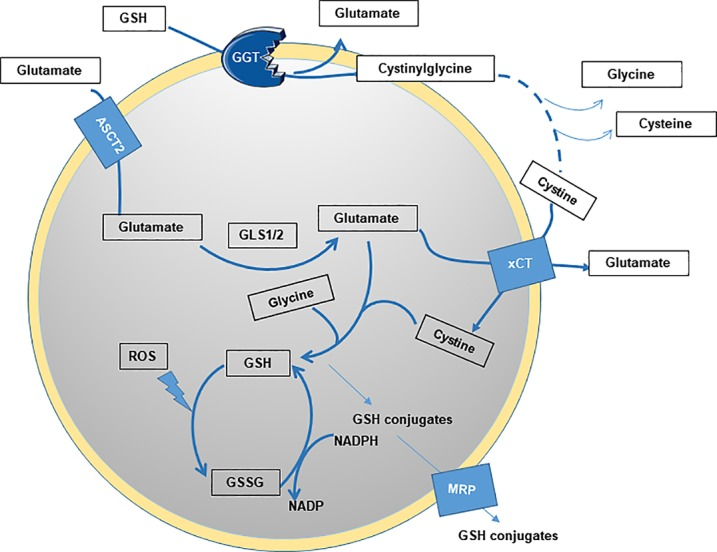
谷胱甘肽(GSH)的生物合成是一个涉及两步酶促反应的过程。首先,在γ-谷氨酰半胱氨酸合成酶(γ-GCS)的催化作用下,谷氨酸和半胱氨酸发生缩合反应,形成 γ-谷氨酰半胱氨酸,这一步反应是GSH合成过程中的限速步骤。γ-GCS是一个异二聚体酶,由催化亚基(GCLC)和调节亚基(GCLM)组成。随后,谷胱甘肽合成酶(GS)催化 γ-谷氨酰半胱氨酸与甘氨酸结合,最终生成GSH[1]。L-Buthionine-sulfoximine(L-BSO,AbMole,M3865)能够特异性地与γ-GCS的活性位点紧密结合,从而阻断γ-GCS的正常催化功能。其抑制作用具有高度的特异性和不可逆性。从化学结构上看,L-BSO 的硫代亚胺基部分与γ-GCS底物半胱氨酸的巯基结构具有一定的相似性,这使得 L-BSO 能够竞争性地结合到 γ-GCS 的活性中心。一旦 L-BSO 与 γ-GCS 结合,便会形成一种稳定的复合物,这种复合物难以解离,从而持续抑制 γ-GCS 的活性[2]。由于γ-GCS活性被抑制,谷氨酸和半胱氨酸无法正常合成γ-谷氨酰半胱氨酸,进而导致GSH生物合成途径受阻,细胞内GSH水平逐渐降低。

1. L-Buthionine-sulfoximine(L-BSO)用于诱导铁死亡
铁死亡是一种新型的程序性细胞死亡方式,其特征在于依赖铁离子的积累以及脂质过氧化产物的大量生成。在形态学上,铁死亡细胞表现为线粒体皱缩、线粒体膜密度增加、线粒体嵴减少或消失等。在生物化学方面,铁死亡过程中伴随着细胞内铁离子浓度升高,脂质过氧化水平显著增强,尤其是多不饱和脂肪酸(PUFA)的过氧化[3]。细胞内的谷胱甘肽过氧化物酶 4(GPX4)在抑制铁死亡过程中发挥着关键作用,它能够利用GSH作为底物,将脂质过氧化物还原为相应的醇,从而阻断脂质过氧化链式反应的发生。L-BSO(L-丁硫氨酸亚砜亚胺,AbMole,M3865) 通过抑制GSH合成,间接诱导细胞发生铁死亡。如前所述,L-BSO作用于γ-GCS,导致GSH合成受阻,细胞内GSH 水平急剧下降[4]。GSH 作为GPX4的底物,其水平降低使得GPX4的活性受到抑制[4]。研究发现,L-BSO(L-Buthionine-sulfoximine)处理后,细胞内转铁蛋白受体(TfR1)表达上调,增加了细胞对铁离子的摄取。过多的铁离子进入细胞后,通过芬顿反应(Fenton reaction)催化过氧化氢产生极具活性的羟自由基,加速脂质过氧化过程[5]。此外,L-BSO处理还可能影响细胞内其他一些与铁死亡相关的代谢途径和信号通路。例如,有研究表明L-BSO(L-Buthionine-(S,R)-sulfoximine)处理后,细胞内的胱氨酸/谷氨酸反向转运体(system Xc−)功能受到抑制,导致细胞对胱氨酸的摄取减少[5, 6]。胱氨酸是合成半胱氨酸的前体物质,半胱氨酸又是GSH合成的关键原料。因此,L-BSO(L-丁硫氨酸亚砜亚胺)对system Xc−的抑制可进一步加剧细胞内GSH的缺乏,促进铁死亡的发生。2014年,AbMole的两款抑制剂分别被西班牙国家心血管研究中心和美国哥伦比亚大学用于动物体内实验,相关科研成果发表于顶刊 Nature 和 Nature Medicine。
2. L-Buthionine-sulfoximine(L-BSO)用于细胞实验
L-Buthionine-sulfoximine(L-BSO,AbMole,M3865)可在多种肿瘤和非肿瘤细胞系中诱导细胞铁死亡。如肝癌细胞系HepG2、肺癌细胞系A549等,给予处理后,均观察到细胞内GSH水平下降、GPX4活性降低、脂质过氧化产物增加以及典型的铁死亡形态学改变,表明L-BSO能够有效地诱导这些细胞发生铁死亡[7]。L-BSO(L-Buthionine-(S,R)-sulfoximine)还可以用于研究细胞的迁移和侵袭能力。在乳腺癌细胞T47D的研究中,L-BSO处理的细胞显示出降低的迁移和侵袭能力[8]。
3. L-BSO在动物模型中的应用
L-Buthionine-sulfoximine(L-BSO,AbMole,M3865)在动物模型实验中被广泛用于研究铁死亡和氧化应激对生理和病理过程的影响。在一项研究中,使用L-BSO处理卵巢癌细胞系OVCAR-3裸鼠肿瘤移植瘤模型。研究发现,L-BSO处理5天(Oral administration),能够显著降低肿瘤细胞内的GSH水平(降低96%),而对骨髓和胃肠道黏膜的GSH水平降低较少。在该模型中,L-BSO预处理后给予烷化剂Melphalan(L-PAM),显著提高了小鼠的中位生存时间(增加了72%),表明L-BSO能够增强肿瘤对烷化剂的敏感性,其机制涉及L-BSO对GSH合成的抑制[9]。在另一项研究中,研究者设计了一种基于铁的金属-有机框架(MOF)纳米平台,共载L-BSO和Oxaliplatin(OXA),用于在4T1乳腺癌移植瘤小鼠中增强肿瘤细胞的铁死亡[10]。此外,L-BSO(L-丁硫氨酸亚砜亚胺)还能用于氧化应激与高血压动物模型的研究,在Sprague-Dawley大鼠模型中,通过饮用水给予30 mM的L-BSO,持续2周。结果显示,L-BSO处理的大鼠肝脏组织中总谷胱甘肽(GSH)含量减少了近5倍,动脉血压显著升高。L-BSO处理的大鼠尿液中亚硝酸盐和硝酸盐(NOx)排泄量显著减少,7周后NOx水平恢复到基线[11]。这表明L-BSO诱导的氧化应激可能通过影响一氧化氮(NO)的代谢并参与上述大鼠高血压的形成[11]。
三、范例详解
1. J Control Release. 2022 Jul;347:55-67.
南方医科大学、广东医科大学的科研团队在上述论文中开发了一种 “蛋黄-壳” 状纳米系统(Bi₂S₃@mBiₓMnᵧOz,即BmB)。该纳米系统经PEG化并负载阿霉素(Doxorubicin,DOX)后形成 PBmB-DOX,可实现肿瘤微环境响应性生物活性物质释放。Bi₂S₃纳米棒核心能沉积更多辐射能量,提高肿瘤细胞对辐照的敏感性。该纳米系统的壳层可催化H₂O₂生成O₂缓解肿瘤缺氧,并通过谷胱甘肽(GSH)耗竭介导GPX4失活,及Mn离子诱导的氧化应激引起肿瘤细胞的铁死亡,同时GSH 刺激的壳层降解有助于自增强 T₁-MR成像。由AbMole提供的L-BSO(L-Buthionine-sulfoximine,AbMole,M3865)在本文中作为谷氨酰半胱氨酸合成酶生物合成抑制剂,用于预处理4T1细胞,以探究GSH在PBmB诱导的化学动力学中的作用。实验显示,经L-BSO预处理后再与PBmB共孵育的细胞,其ROS产生的绿色荧光明显弱于仅用PBmB处理的细胞,表明GSH丰富的环境可激活 PBmB 诱导的CDT,L-BSO通过减少GSH从而抑制了该过程[12]。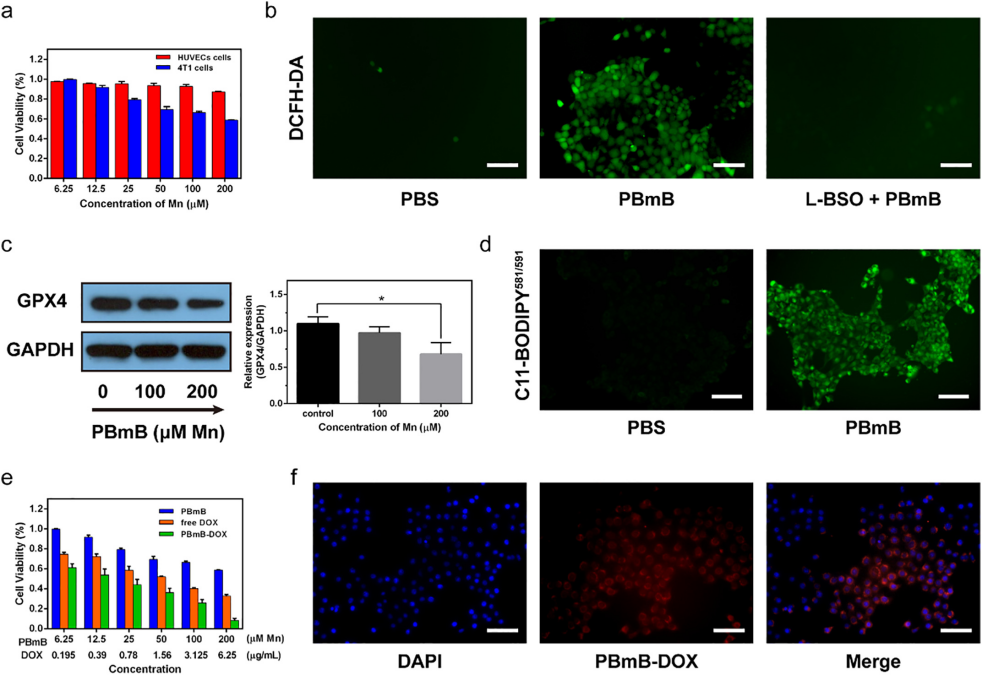

AbMole是ChemBridge中国区官方指定合作伙伴。


参考文献及鸣谢
[1] A. Bansal, M. C. Simon, Glutathione metabolism in cancer progression and treatment resistance, The Journal of cell biology 217(7) (2018) 2291-2298.
[2] J. P. Fruehauf, S. Zonis, M. al-Bassam, et al., Selective and synergistic activity of L-S,R-buthionine sulfoximine on malignant melanoma is accompanied by decreased expression of glutathione-S-transferase, Pigment cell research 10(4) (1997) 236-49.
[3] X. Jiang, B. R. Stockwell, M. Conrad, Ferroptosis: mechanisms, biology and role in disease, Nature reviews. Molecular cell biology 22(4) (2021) 266-282.
[4] Xiang Xu, Fang Wang, Rengan Luo, et al., Hijacking cysteine metabolism for reversing hydrogen sulfide production in enhanced ferroptosis therapy, 490(000) (2024).
[5] Wan Seok Yang, Brent R. %J Trends in cell biology Stockwell, Ferroptosis: Death by Lipid Peroxidation, 26(3) (2015) 165-176.
[6] R. Albano, N. J. Raddatz, J. Hjelmhaug, et al., Regulation of System xc(-) by Pharmacological Manipulation of Cellular Thiols, Oxidative medicine and cellular longevity 2015 (2015) 269371.
[7] C. Dos Reis Oliveira, J. C. Pereira, A. Barros Ibiapina, et al., Buthionine sulfoximine and chemoresistance in cancer treatments: a systematic review with meta-analysis of preclinical studies, Journal of toxicology and environmental health. Part B, Critical reviews 26(8) (2023) 417-441.
[8] E. H. Mustafa, H. T. Mahmoud, M. Y. Al-Hudhud, et al., 2-deoxy-D-Glucose Synergizes with Doxorubicin or L-Buthionine Sulfoximine to Reduce Adhesion and Migration of Breast Cancer Cells, Asian Pacific journal of cancer prevention : APJCP 16(8) (2015) 3213-22.
[9] R. F. Ozols, K. G. Louie, J Plowman, et al., Enhanced melphalan cytotoxicity in human ovarian cancer in vitro and in tumor-bearing nude mice by buthionine sulfoximine depletion of glutathione, 36(1) (1987) 147-153.
[10] Iron-based metal-organic framework co-loaded with buthionine sulfoximine and oxaliplatin for enhanced cancer chemo-ferrotherapy via sustainable glutathione elimination %J Journal of nanobiotechnology, 21(1) 265.
[11] N. D. Vaziri, Y. Ding, Z. Ni, Compensatory up-regulation of nitric-oxide synthase isoforms in lead-induced hypertension; reversal by a superoxide dismutase-mimetic drug, The Journal of pharmacology and experimental therapeutics 298(2) (2001) 679-85.
[12] M. Hou, K. Zhu, H. Hu, et al., Rapid synthesis of 'yolk-shell'-like nanosystem for MR molecular and chemo-radio sensitization, Journal of controlled release : official journal of the Controlled Release Society 347 (2022) 55-67.
一、L-Buthionine-sulfoximine(L-BSO)的作用机制
谷胱甘肽(GSH)的生物合成是一个涉及两步酶促反应的过程。首先,在γ-谷氨酰半胱氨酸合成酶(γ-GCS)的催化作用下,谷氨酸和半胱氨酸发生缩合反应,形成 γ-谷氨酰半胱氨酸,这一步反应是GSH合成过程中的限速步骤。γ-GCS是一个异二聚体酶,由催化亚基(GCLC)和调节亚基(GCLM)组成。随后,谷胱甘肽合成酶(GS)催化 γ-谷氨酰半胱氨酸与甘氨酸结合,最终生成GSH[1]。L-Buthionine-sulfoximine(L-BSO,AbMole,M3865)能够特异性地与γ-GCS的活性位点紧密结合,从而阻断γ-GCS的正常催化功能。其抑制作用具有高度的特异性和不可逆性。从化学结构上看,L-BSO 的硫代亚胺基部分与γ-GCS底物半胱氨酸的巯基结构具有一定的相似性,这使得 L-BSO 能够竞争性地结合到 γ-GCS 的活性中心。一旦 L-BSO 与 γ-GCS 结合,便会形成一种稳定的复合物,这种复合物难以解离,从而持续抑制 γ-GCS 的活性[2]。由于γ-GCS活性被抑制,谷氨酸和半胱氨酸无法正常合成γ-谷氨酰半胱氨酸,进而导致GSH生物合成途径受阻,细胞内GSH水平逐渐降低。


图 1. GSH的生物合成[1]
二、L-Buthionine-sulfoximine(L-BSO)的科研应用1. L-Buthionine-sulfoximine(L-BSO)用于诱导铁死亡
铁死亡是一种新型的程序性细胞死亡方式,其特征在于依赖铁离子的积累以及脂质过氧化产物的大量生成。在形态学上,铁死亡细胞表现为线粒体皱缩、线粒体膜密度增加、线粒体嵴减少或消失等。在生物化学方面,铁死亡过程中伴随着细胞内铁离子浓度升高,脂质过氧化水平显著增强,尤其是多不饱和脂肪酸(PUFA)的过氧化[3]。细胞内的谷胱甘肽过氧化物酶 4(GPX4)在抑制铁死亡过程中发挥着关键作用,它能够利用GSH作为底物,将脂质过氧化物还原为相应的醇,从而阻断脂质过氧化链式反应的发生。L-BSO(L-丁硫氨酸亚砜亚胺,AbMole,M3865) 通过抑制GSH合成,间接诱导细胞发生铁死亡。如前所述,L-BSO作用于γ-GCS,导致GSH合成受阻,细胞内GSH 水平急剧下降[4]。GSH 作为GPX4的底物,其水平降低使得GPX4的活性受到抑制[4]。研究发现,L-BSO(L-Buthionine-sulfoximine)处理后,细胞内转铁蛋白受体(TfR1)表达上调,增加了细胞对铁离子的摄取。过多的铁离子进入细胞后,通过芬顿反应(Fenton reaction)催化过氧化氢产生极具活性的羟自由基,加速脂质过氧化过程[5]。此外,L-BSO处理还可能影响细胞内其他一些与铁死亡相关的代谢途径和信号通路。例如,有研究表明L-BSO(L-Buthionine-(S,R)-sulfoximine)处理后,细胞内的胱氨酸/谷氨酸反向转运体(system Xc−)功能受到抑制,导致细胞对胱氨酸的摄取减少[5, 6]。胱氨酸是合成半胱氨酸的前体物质,半胱氨酸又是GSH合成的关键原料。因此,L-BSO(L-丁硫氨酸亚砜亚胺)对system Xc−的抑制可进一步加剧细胞内GSH的缺乏,促进铁死亡的发生。2014年,AbMole的两款抑制剂分别被西班牙国家心血管研究中心和美国哥伦比亚大学用于动物体内实验,相关科研成果发表于顶刊 Nature 和 Nature Medicine。
2. L-Buthionine-sulfoximine(L-BSO)用于细胞实验
L-Buthionine-sulfoximine(L-BSO,AbMole,M3865)可在多种肿瘤和非肿瘤细胞系中诱导细胞铁死亡。如肝癌细胞系HepG2、肺癌细胞系A549等,给予处理后,均观察到细胞内GSH水平下降、GPX4活性降低、脂质过氧化产物增加以及典型的铁死亡形态学改变,表明L-BSO能够有效地诱导这些细胞发生铁死亡[7]。L-BSO(L-Buthionine-(S,R)-sulfoximine)还可以用于研究细胞的迁移和侵袭能力。在乳腺癌细胞T47D的研究中,L-BSO处理的细胞显示出降低的迁移和侵袭能力[8]。
3. L-BSO在动物模型中的应用
L-Buthionine-sulfoximine(L-BSO,AbMole,M3865)在动物模型实验中被广泛用于研究铁死亡和氧化应激对生理和病理过程的影响。在一项研究中,使用L-BSO处理卵巢癌细胞系OVCAR-3裸鼠肿瘤移植瘤模型。研究发现,L-BSO处理5天(Oral administration),能够显著降低肿瘤细胞内的GSH水平(降低96%),而对骨髓和胃肠道黏膜的GSH水平降低较少。在该模型中,L-BSO预处理后给予烷化剂Melphalan(L-PAM),显著提高了小鼠的中位生存时间(增加了72%),表明L-BSO能够增强肿瘤对烷化剂的敏感性,其机制涉及L-BSO对GSH合成的抑制[9]。在另一项研究中,研究者设计了一种基于铁的金属-有机框架(MOF)纳米平台,共载L-BSO和Oxaliplatin(OXA),用于在4T1乳腺癌移植瘤小鼠中增强肿瘤细胞的铁死亡[10]。此外,L-BSO(L-丁硫氨酸亚砜亚胺)还能用于氧化应激与高血压动物模型的研究,在Sprague-Dawley大鼠模型中,通过饮用水给予30 mM的L-BSO,持续2周。结果显示,L-BSO处理的大鼠肝脏组织中总谷胱甘肽(GSH)含量减少了近5倍,动脉血压显著升高。L-BSO处理的大鼠尿液中亚硝酸盐和硝酸盐(NOx)排泄量显著减少,7周后NOx水平恢复到基线[11]。这表明L-BSO诱导的氧化应激可能通过影响一氧化氮(NO)的代谢并参与上述大鼠高血压的形成[11]。
三、范例详解
1. J Control Release. 2022 Jul;347:55-67.
南方医科大学、广东医科大学的科研团队在上述论文中开发了一种 “蛋黄-壳” 状纳米系统(Bi₂S₃@mBiₓMnᵧOz,即BmB)。该纳米系统经PEG化并负载阿霉素(Doxorubicin,DOX)后形成 PBmB-DOX,可实现肿瘤微环境响应性生物活性物质释放。Bi₂S₃纳米棒核心能沉积更多辐射能量,提高肿瘤细胞对辐照的敏感性。该纳米系统的壳层可催化H₂O₂生成O₂缓解肿瘤缺氧,并通过谷胱甘肽(GSH)耗竭介导GPX4失活,及Mn离子诱导的氧化应激引起肿瘤细胞的铁死亡,同时GSH 刺激的壳层降解有助于自增强 T₁-MR成像。由AbMole提供的L-BSO(L-Buthionine-sulfoximine,AbMole,M3865)在本文中作为谷氨酰半胱氨酸合成酶生物合成抑制剂,用于预处理4T1细胞,以探究GSH在PBmB诱导的化学动力学中的作用。实验显示,经L-BSO预处理后再与PBmB共孵育的细胞,其ROS产生的绿色荧光明显弱于仅用PBmB处理的细胞,表明GSH丰富的环境可激活 PBmB 诱导的CDT,L-BSO通过减少GSH从而抑制了该过程[12]。


图 2. Fluorescent images of ROS production in 4T1 cells after different treatments (treated with PBS or PBmB or L-BSO + PBmB)[12]
AbMole是ChemBridge中国区官方指定合作伙伴。


参考文献及鸣谢
[1] A. Bansal, M. C. Simon, Glutathione metabolism in cancer progression and treatment resistance, The Journal of cell biology 217(7) (2018) 2291-2298.
[2] J. P. Fruehauf, S. Zonis, M. al-Bassam, et al., Selective and synergistic activity of L-S,R-buthionine sulfoximine on malignant melanoma is accompanied by decreased expression of glutathione-S-transferase, Pigment cell research 10(4) (1997) 236-49.
[3] X. Jiang, B. R. Stockwell, M. Conrad, Ferroptosis: mechanisms, biology and role in disease, Nature reviews. Molecular cell biology 22(4) (2021) 266-282.
[4] Xiang Xu, Fang Wang, Rengan Luo, et al., Hijacking cysteine metabolism for reversing hydrogen sulfide production in enhanced ferroptosis therapy, 490(000) (2024).
[5] Wan Seok Yang, Brent R. %J Trends in cell biology Stockwell, Ferroptosis: Death by Lipid Peroxidation, 26(3) (2015) 165-176.
[6] R. Albano, N. J. Raddatz, J. Hjelmhaug, et al., Regulation of System xc(-) by Pharmacological Manipulation of Cellular Thiols, Oxidative medicine and cellular longevity 2015 (2015) 269371.
[7] C. Dos Reis Oliveira, J. C. Pereira, A. Barros Ibiapina, et al., Buthionine sulfoximine and chemoresistance in cancer treatments: a systematic review with meta-analysis of preclinical studies, Journal of toxicology and environmental health. Part B, Critical reviews 26(8) (2023) 417-441.
[8] E. H. Mustafa, H. T. Mahmoud, M. Y. Al-Hudhud, et al., 2-deoxy-D-Glucose Synergizes with Doxorubicin or L-Buthionine Sulfoximine to Reduce Adhesion and Migration of Breast Cancer Cells, Asian Pacific journal of cancer prevention : APJCP 16(8) (2015) 3213-22.
[9] R. F. Ozols, K. G. Louie, J Plowman, et al., Enhanced melphalan cytotoxicity in human ovarian cancer in vitro and in tumor-bearing nude mice by buthionine sulfoximine depletion of glutathione, 36(1) (1987) 147-153.
[10] Iron-based metal-organic framework co-loaded with buthionine sulfoximine and oxaliplatin for enhanced cancer chemo-ferrotherapy via sustainable glutathione elimination %J Journal of nanobiotechnology, 21(1) 265.
[11] N. D. Vaziri, Y. Ding, Z. Ni, Compensatory up-regulation of nitric-oxide synthase isoforms in lead-induced hypertension; reversal by a superoxide dismutase-mimetic drug, The Journal of pharmacology and experimental therapeutics 298(2) (2001) 679-85.
[12] M. Hou, K. Zhu, H. Hu, et al., Rapid synthesis of 'yolk-shell'-like nanosystem for MR molecular and chemo-radio sensitization, Journal of controlled release : official journal of the Controlled Release Society 347 (2022) 55-67.
相关文章
更多 >

