工程化外泌体助力药物递送和靶向治疗
2025-10-10 来源:本站 点击次数:42外泌体是细胞界的“快递小哥”,是细胞间传递物资的能手。如今科学家改造外泌体,打造出“药物专车”,能精准送药到指定细胞或组织,十分智能。快来跟着小 M 探索有前途的下一代靶向给药系统!
外泌体是细胞分泌的纳米级细胞外囊泡,近期成为颇具前景的药物递送载体。它有脂质双层膜,包裹蛋白质、脂质和核酸等生物活性物质,具高生物相容性和低免疫原性,能降低免疫清除率、促进靶向药物运输。然而,天然外泌体临床应用受循环半衰期短、细胞来源变异性及载药能力不足等因素限制。为此,研究人员借助生物工程技术研发工程外泌体,以增强药物封装和靶向性。通常,工程外泌体具有防止聚集、吸附和快速清除,维持更高药物负载量和稳定性,还能高效定制药物递送系统,已成为生物医学和生物技术领域热门研究方向。
生物工程技术可提升外泌体产生量、稳定性与纯度。经亲本细胞基因改造生成的工程外泌体,是有前景的药物递送载体。先从体液中分离外泌体,再设计使其表面携带特定货物或表达配体。探究其潜在临床用途前,需评估工程外泌体载药能力 (图 1)。此外,工程外泌体有药物保护、增强稳定性和生物利用度、降低毒性、提升靶向能力等优势[2]。
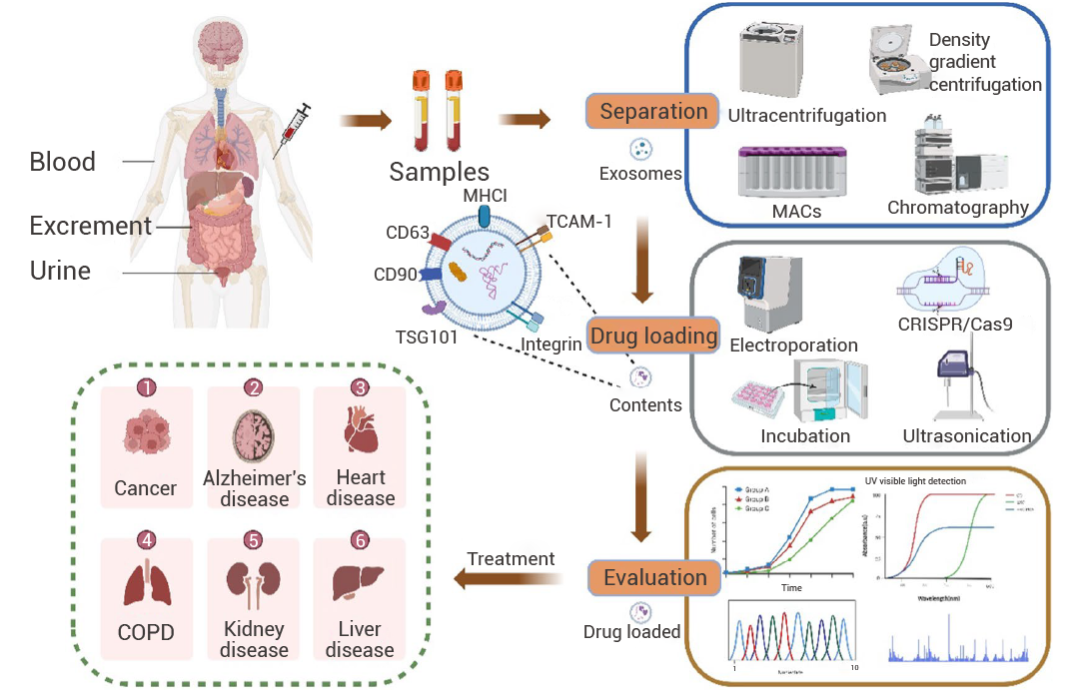 图 1. 用于治疗应用的外泌体工程化过程概述[2]。
图 1. 用于治疗应用的外泌体工程化过程概述[2]。
Section.01
外泌体包载药物
工程化外泌体的药物包载方法主要可分为两种技术类型:内源性包载和外源性包载。内源性包载主要借助 CRISPR/Cas9 技术在细胞内实现药物包载。外源性包载方法则涵盖孵育、电穿孔、超声处理、冻融循环,以及在外泌体分离后通过挤出方式包载药物。
内源性包载药物
该方法用基因工程技术转染供体细胞,使其表达所需物质,再从供体细胞培养上清液中分离含生物活性物质的外泌体。以 CRISPR/Cas9 系统为例,它有治疗癌症前景,但临床转化受免疫原性等制约,而工程外泌体可克服此限制。外泌体与 CRISPR/Cas9 系统包装后,能与癌细胞膜结合,实现高效非侵入性基因编辑。一项研究显示,负载 CRISPR/Cas9 的外泌体可诱导卵巢癌细胞凋亡,凸显其精准抗癌治疗潜力。
此外,外泌体还被作为癌症疫苗研究,相比传统化疗,有特异性高、可控且无毒等优势。最近研究表明,M1 极化巨噬细胞释放的外泌体与癌症疫苗联合给药,可增强小鼠模型的疫苗免疫原性和抗肿瘤免疫反应,揭示了工程外泌体在开发优化抗癌疫苗方面的治疗潜力。
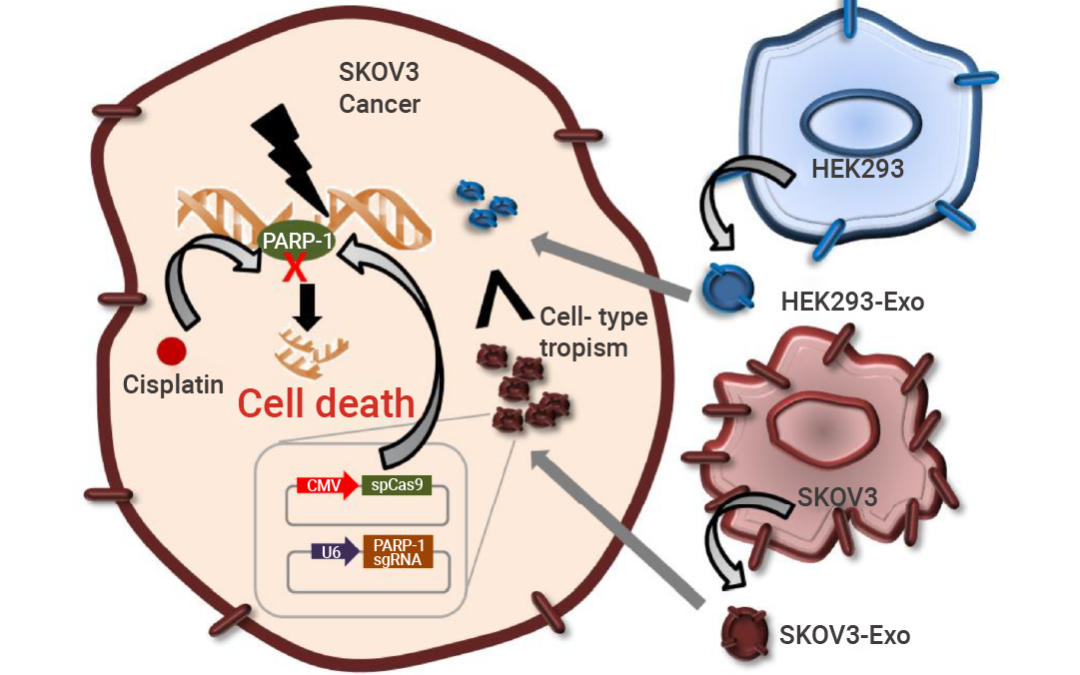 图 2. 癌症来源的外泌体作为 CRISPR/Cas9 的递送平台赋予癌细胞趋向性依赖性靶向[3]。
图 2. 癌症来源的外泌体作为 CRISPR/Cas9 的递送平台赋予癌细胞趋向性依赖性靶向[3]。
外源性包载药物
该方法先对外泌体进行分离,随后运用各类技术在外部掺入药物或生物活性物质。相较于内源性包载法,外源性包载法具备诸多优点。它为大规模生产工程化外泌体提供了更简便的操作、更高的稳定性以及更优的可扩展性。
常见的外源性包载药物的方法有共孵育、电穿孔、超声处理、冻融循环和挤出法。这些技术提供了一种通用且高效的方式,可将治疗剂包载到外泌体中以实现靶向递送。
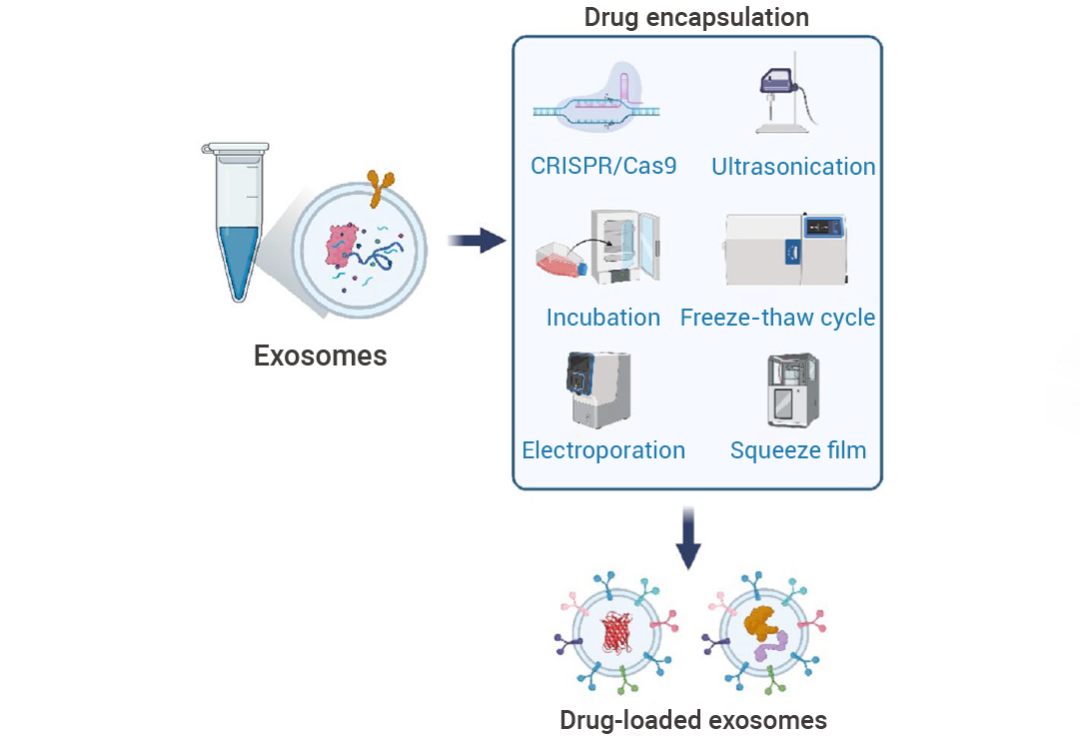 图 3. 内源性和外源性包载药物的方式[2]。
图 3. 内源性和外源性包载药物的方式[2]。
Section.02
用于药物递送和靶向治疗的
工程化外泌体
表面工程
表面工程旨在赋予细胞类型靶向特异性。其修饰策略涵盖遗传工程和化学修饰。借助生物融合表达,将靶向肽的基因序列与选定的外泌体膜蛋白的基因序列相融合,可有效在外泌体表面展示靶向肽。化学修饰则通过缀合反应或脂质组装来展示各类天然和合成配体,不过外泌体表面的复杂性可能会降低反应效率,甚至对载体的结构和功能造成损害。目前,众多研究采用生物融合表达的方法对外泌体表面蛋白进行修饰。
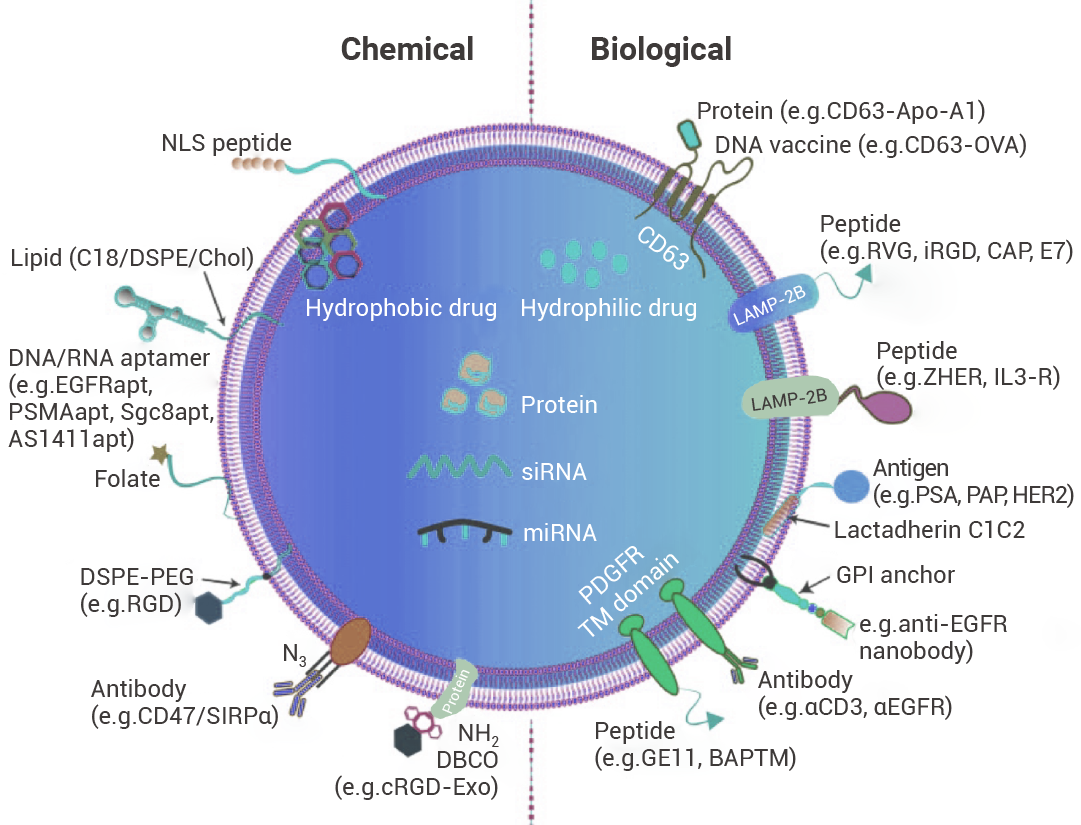 图 4. 借助遗传/生物操作或化学修饰对外泌体表面实施工程化改造[5]。
图 4. 借助遗传/生物操作或化学修饰对外泌体表面实施工程化改造[5]。
遗传工程和靶向基序展示
外泌体膜天然含有蛋白质,如四跨蛋白、整合素和凝集素。这些蛋白质可以通过与靶细胞受体的相互作用来影响外泌体生物分布。通过基因调节亲本细胞以过表达或敲低特定蛋白质,可以显着增强工程外泌体的靶向能力。
细胞结合基序可以通过蛋白工程方法展示在外泌体表面,这些方法通常包括使用病毒靶向基序、细胞穿透肽和蛋白质转染域。值得注意的是,这些元素中的每一种在增强外泌体靶向和穿透细胞的能力方面都发挥着独特的作用,这使得它们成为靶向药物递送和疾病治疗领域中有价值的工具。
|
产品推荐 |
|
一种专门为外泌体样本设计的一款裂解液,可高效裂解外泌体蛋白 |
|
可快速高效地从细胞培养上清中分离纯化外泌体 |
|
可快速高效地从脑脊液、羊水、乳汁、唾液、肺泡灌洗液及鼻腔盥洗液等体液中分离纯化外泌体 |
|
无血清培养的 293T 细胞上清液中分离纯化得到的高纯度外泌体颗粒 |
|
从无血清培养的人脐带间充质干细胞 (MSC) 上清液中分离纯化得到的高纯度外泌体颗粒 |

[1] Joorabloo A,et al. Engineering exosome-based biomimetic nanovehicles for wound healing. J Controlled Release. 2023;356:463–80.
[2] Chen Z, et al. Encapsulation and assessment of therapeutic cargo in engineered exosomes: a systematic review. J Nanobiotechnology. 2024 Jan 3;22(1):18.
[3] Kim SM, et al. Cancer-derived exosomes as a delivery platform of CRISPR/Cas9 confer cancer cell tropism-dependent targeting. J Controlled Release. 2017;266:8–16.
[4] Gunassekaran GR, et al. M1 macrophage exosomes engineered to foster M1 polarization and target the IL-4 receptor inhibit tumor growth by reprogramming tumor-associated macrophages into M1-like macrophages. Biomaterials. 2021;278: 121137.
[5] Liang Y, et al. Engineering exosomes for targeted drug delivery. Theranostics. 2021 Jan 1;11(7):3183-3195.



