空间转录组助力揭示脂肪肝相关肝癌中的免疫抑制和微环境重塑
2025-11-04 来源:本站 点击次数:26
题目:Targeting Treg–fibroblast interaction to enhance immunotherapy in steatotic liver disease-related hepatocellular carcinoma
期刊:Gut
IF:25.8
DOI:10.1136/gutjnl-2025-335084
研究背景
脂肪相关肝细胞癌(SLD-HCC)作为全球性的健康难题,其肿瘤微环境(TME)展现出独特的代谢与免疫适应特性。SLD-HCC不仅引发免疫抑制,还会影响免疫疗法的治疗效果。尽管近年来免疫疗法在肝癌治疗中取得了显著进展,但SLD-HCC的应答率依然偏低。已有研究指出,SLD-HCC中调控性T细胞(Tregs)和癌相关纤维母细胞(CAFs)之间的交互起着重要作用,但相关机制尚未得到充分的解释。本研究通过整合单细胞转录组(10x Genomics)及两种空间转录组平台(Visium和CosMx SMI),系统揭示了SLD-HCC TME的演化轨迹,深入探讨了免疫监视逐渐失效及肿瘤微环境重塑的过程,为突破免疫疗法抑制提供了新的思路。
实验设计与技术手段
本研究纳入了22例SLD-HCC和31例非SLD-HCC患者的样本,采用多组学方法深入探讨肿瘤微环境(TME)的特征。研究重点依托以下技术手段:
单细胞转录组(10x Genomics):分析患者的肿瘤和非肿瘤组织样本,揭示不同细胞类型之间的互作关系,帮助理解肿瘤微环境中的免疫和代谢特征。
空间转录组(Visium):对肿瘤组织进行空间转录组分析,描绘肿瘤边缘等关键位置的细胞分布及其分子特征,为揭示肿瘤微环境的空间差异提供关键线索。
空间转录组(CosMx SMI):通过高分辨率的单细胞空间转录组,探索肿瘤微环境中细胞的邻域关系,进一步细化免疫抑制机制的局部特征。
多种技术手段协同作用,揭示了SLD-HCC的细胞异质性和空间组织特征,并通过CyTOF、多重免疫荧光和小鼠模型进行验证,增强了研究的全面性和可靠性。
主要发现
1.单细胞转录组揭示免疫和脂质代谢通路的显著变化
通过scRNA-seq分析,发现SLD-HCC中调控性T细胞(Tregs)、癌相关纤维母细胞(CAFs)和内皮细胞(ECs)等细胞类型显著上调了脂质代谢相关基因(如APOA2和FABP1),同时Tregs下调了抗原呈递基因(HLA-DRB5)和激活标志物(IL2RA),而CD8+ T细胞则表现出毒性基因(CST7)的下调。这些变化表明,高脂肿瘤微环境驱动了细胞的代谢适应,从而引发整体免疫抑制状态。
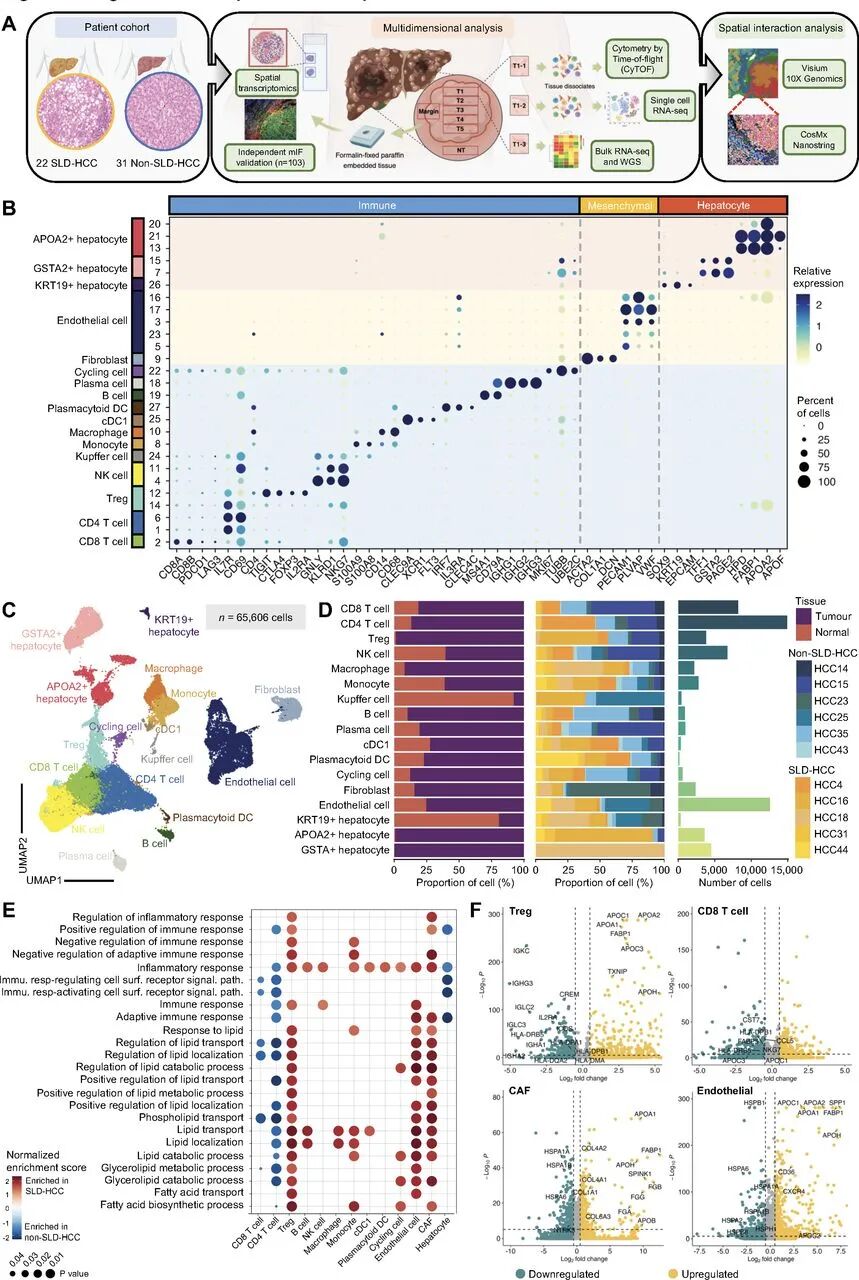 单细胞转录组揭示SLD-HCC TME的脂质代谢与免疫变化
单细胞转录组揭示SLD-HCC TME的脂质代谢与免疫变化2.Visium空间转录组描绘Treg-CAF簇的空间组织特征
Visium数据显示,在SLD-HCC的肿瘤边缘,免疫细胞与纤维母细胞高度共定位,形成了一个免疫抑制的微环境区域。进一步的解卷积分析发现Treg-CAF簇显著富集.。同时, TNFSF14–TNFRSF14(肿瘤坏死因子超家族成员与其受体)的交互强度增强,进一步推动了肿瘤细胞的免疫逃逸。
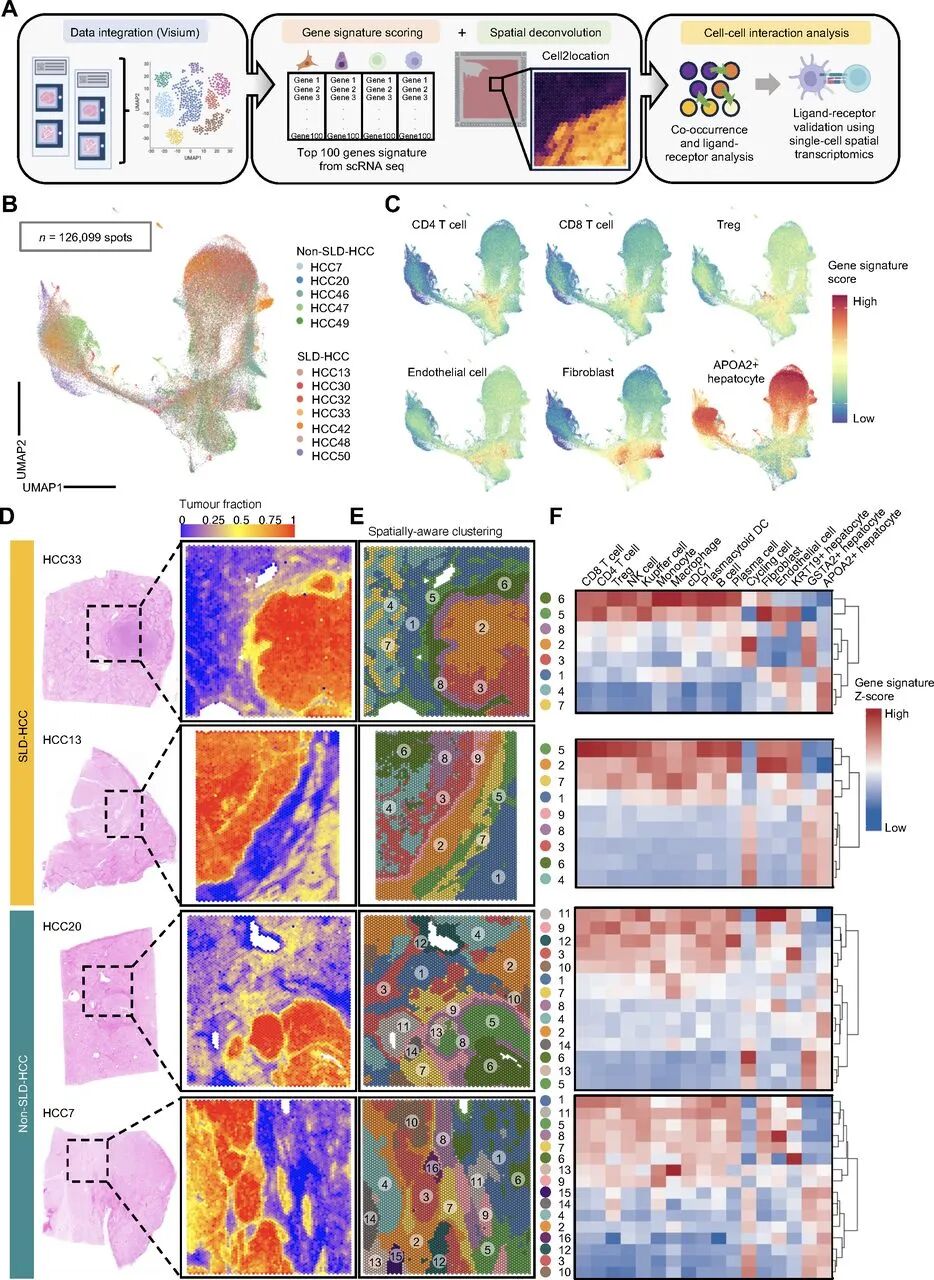 Visium空间转录组解析SLD-HCC边缘Treg-CAF簇
Visium空间转录组解析SLD-HCC边缘Treg-CAF簇3.CosMx SMI空间转录组揭示Treg-CAF交互驱动免疫疗法抵抗
通过CosMx SMI分析发现,SLD-HCC中Tregs与CAFs呈现出显著的邻域富集(涉及25种细胞类型),并伴随HLA-E(人类白细胞抗原E,抑制免疫细胞活性)等抑制分子的上调。结合细胞通讯分析,发现TNFSF14-TNFRSF14轴在早期前体阶段已启动激活,与CD8+ T细胞的耗竭以及Tregs的积累密切相关,从而加剧了肿瘤对免疫疗法的抵抗。
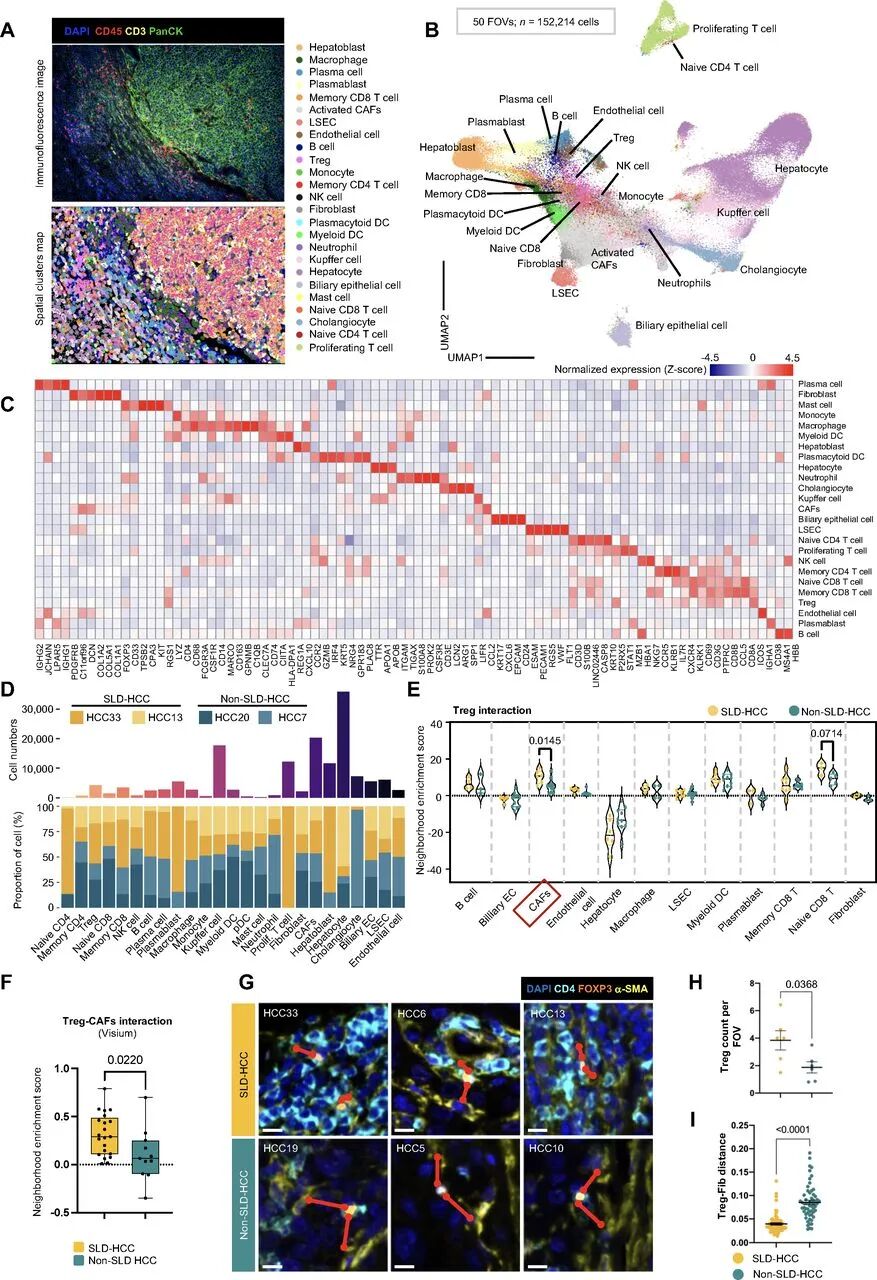 CosMx SMI描绘SLD-HCC Treg-CAF免疫抑制网络
CosMx SMI描绘SLD-HCC Treg-CAF免疫抑制网络4.构建免疫演化模型并验证治疗潜力
单细胞和空间转录组共同勾勒出SLD-HCC从免疫监视向免疫抑制转变的连续路径。验证实验表明,在高脂饮食诱导的HCC小鼠模型中,阻断TNFRSF14不仅减少了Tregs,还提升了活性CD8+和记忆CD4+ T细胞的水平,并与anti-PD-1(抗PD-1免疫检查点抑制剂)疗法产生协同效应,最终缩小肿瘤体积。研究证实了该信号轴作为免疫疗法抵抗的关键驱动因素。
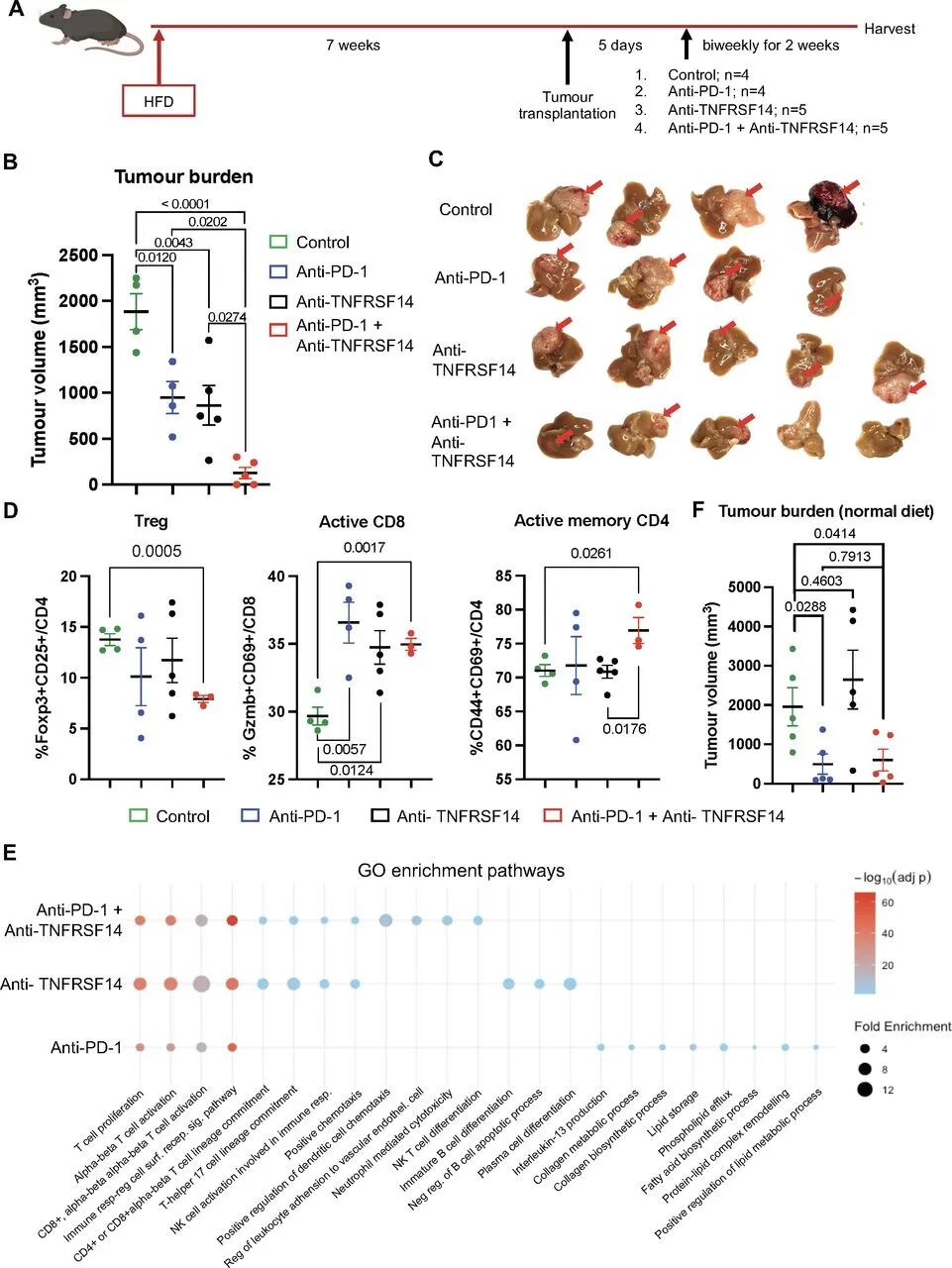 小鼠模型验证TNFRSF14阻断与anti-PD-1协同疗效
小鼠模型验证TNFRSF14阻断与anti-PD-1协同疗效文章总结
本研究利用scRNA-seq和Visium/CosMx空间转录组平台,全面绘制了SLD-HCC肿瘤微环境(TME)的分子图谱。研究发现,高脂环境促进了Tregs和CAFs的脂质代谢适应,而TNFSF14-TNFRSF14信号轴通过空间组织形成免疫抑制微环境区域,从而加剧了免疫疗法抵抗。基于这些发现,研究提出了“免疫监视→免疫抑制→免疫逃逸”的演化模型,为SLD-HCC的早期干预和免疫疗法开发提供了重要的分子靶点和理论支持。
相关文章
更多 >

