高剪切应力降低 ERG,导致内皮细胞间充质转化和肺动脉高压
2025-11-17 来源:本站 点击次数:139High Shear Stress Reduces ERG Causing Endothelial-Mesenchymal Transition and Pulmonary Arterial Hypertension
Keywords: ERG; aorto-caval shunt mice; endothelial cells; endothelial-mesenchymal transition; pulmonary arterial hypertension; shear stress.
研究显示,先天性心脏病(CHD)的外周肺动脉(PAs)中存在高剪应力(HSS;100 dyn/cm2),如室间隔缺损病伴肺动脉高压(PAH)。在动物模型中,病理性HSS已被作为诱导PAH的因素进行了研究,然而,HSS 触发和诱导肺血管变化进展的机制尚不清楚,最终导致肺血管阻力(PVR)和严重 PAH的不可逆上升。相对于静态条件,当PA内皮细胞(PAECs)承受生理层流剪切应力(LSS;15 dyn/cm2)时,KLF 2/4 及其与 SWI/SNF染色质重塑因子的相互作用增加,这导致 NOS3(一氧化氮合酶3)、BMPR2(骨形态发生蛋白受体2)和 SMAD5(SMAD 家族成员5)等保护性基因的诱导,以及与血管收缩和平滑肌细胞增殖相关的基因的抑制,例如 EDN1(内皮素1)。
点击了解:仿生流体剪切应力系统
ERG(ETS转录因子家族)促进 KLF2与血栓调节蛋白启动子结合,维持LSS下的抗凝作用。ERG 驱动 SMAD1,同时抑制 SMAD3 活性以防止内皮细胞间充质转化 (EndMT)。ERG的缺失与 NF-κB(核因子-κB)活性和 EndMT 的抑制有关。在 PAH 患者肺组织 PAs 中也观察到 ERG 降低,BMPR2 和 ERG 被认为是协同调节以维持 PAEC 稳态。PAH 患者存在 BMPR2 的突变和表达或功能降低并且还与 EndMT 相关联。BMPR2缺失导致 EndMT 的机制与染色质重塑蛋白HMGA1(高迁移率蛋白A1)的增加有关。
基于此,在美国斯坦福心血管研究所、Betty Irene Moore 儿童心脏中心及日本名古屋市立大学医学研究科新生儿儿科等团队的一项研究中,将 PAEC 暴露于与动脉(直径<500μm) PAH 相关的HSS ,然后确定了这种水平的HSS是否介导BMPR2的下降并诱导EndMT,所涉及的机制是否与KLF2/4的下降或ERG介导的基因调控有关,以及恢复下降的转录因子是否可以防止培养细胞中BMPR2的降低和随后的EndMT。研究成果发表于 Arteriosclerosis, Thrombosis, and Vascular Biology 期刊题为“High Shear Stress Reduces ERG Causing Endothelial-Mesenchymal Transition and Pulmonary Arterial Hypertension”。

首先,利用体外系统将 HSS(100 dyn/cm2;24h)与 LSS(15 dyn/cm2;24h)递送给人 PAECs。结果发现,与 LSS 相比,仅 24 小时的 HSS 诱导 EndMT 特征,蛋白质免疫印迹评估显示,转录因子SNAI1/2 和间充质标志物 ACTA2 增加,EC 表面标志物 PECAM1 和 CDH5 减少(图1 A)。免疫荧光成像证实了这些发现,并通过另一种间充质标志物和 EndMT 标志物 FSP1(成纤维细胞特异性蛋白-1)的增加来扩展这些发现(图1 B)。然后,试确定 HSS 介导的 EndMT 是否可能与 BMPR2 的减少有关,并且确实观察到 HSS 介导的该受体的 mRNA 和蛋白质水平降低(图1 C、D)。最近的研究表明,KLF2 的 N6-甲基腺苷修饰可能有助于 EndMT。然而,血流诱导的转录因子KLF2/4没有被HSS改变(图1 E、F)。这些数据表明,病理性HSS诱导EndMT。
然后,为了确定哪些转录因子结合位点可能会因 HSS 而失去活性,对 LSS、HSS 和静态培养条件下的 PAEC 进行了 H3K27ac CUT&RUN。在全基因组范围内,对H3K27ac活性降低的峰值进行基序富集分析,确定了来自SOX(SRY-box转录因子)和ETS(E-26)转录因子家族中的几个候选基序,包括ERG,这是一种可以与KLF2和 SWI/SNF相互作用的先锋因子。进一步测定表明,LSS下KLF4与ERG的相互作用在HSS下显著减少。这表明,ERG 降低可能有助于 HSS 诱导的 EndMT。确实,HSS 显著降低了 ERG mRNA 和蛋白质水平。此外,还通过共聚焦成像对移植时切除的 PAH 患者和未使用的供体肺作为对照的患者的人肺组织切片进行 ERG 核表达评估。与对照组 PAs 相比,IPAH 或伴有室间隔缺损的相关 PAH-CHD 患者的 PAs 核 ERG 表达显著降低。这些数据表明,病理性HSS降低ERG表达。
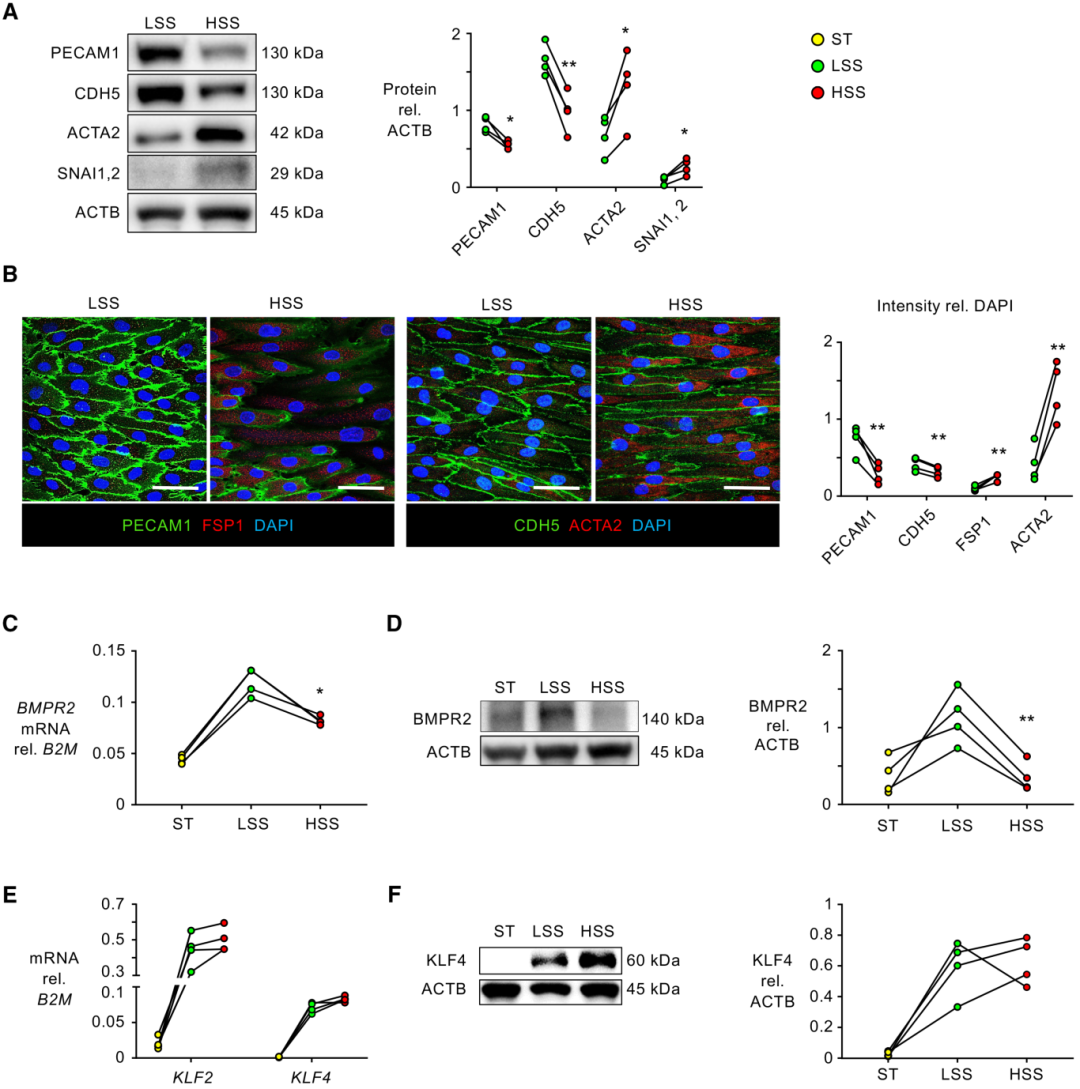
图1 高剪切应力(HSS)诱导内皮细胞向间质转化(EndMT)。
接下来,为了确定ERG的减少是否足以诱导EndMT,用ERG siRNA转染PAECs,将细胞暴露于LSS。蛋白质免疫印迹评估显示,PECAM1和CDH5蛋白水平降低,ACTA2和SNAI1/2水平升高。mRNA水平反映PECAM1和CDH5的降低以及ACTA2的增加,但SNAI1或SNAI2没有改变,这表明这些转录因子的mRNA升高可能是短暂的。共聚焦图像显示,PECAM1和CDH5降低,ACTA2增加。在LSS下,ERG siRNA也降低了BMPR2 mRNA和蛋白质水平。
上述研究表明,在 LSS 下降低 ERG 足以诱导 EndMT,因此随后确定了在 HSS 下替换 ERG 是否会阻止 EndMT。转染慢病毒载体的ERG在HSS下增加了ERG,并通过蛋白质免疫印迹检测到PECAM1和CDH5的增加以及ACTA2和SNAI1/2的减少验证了阻止EndMT(图2 A)。通过共聚焦成像也观察到这些发现(图2 B)。HSS下的BMPR2基因和蛋白表达也通过转染ERG增加(图2 C、D)。ERG的表达降低了细胞的纵横比,与内皮表型的恢复一致。这说明,在HSS下转导 ERG 可防止 EndMT。
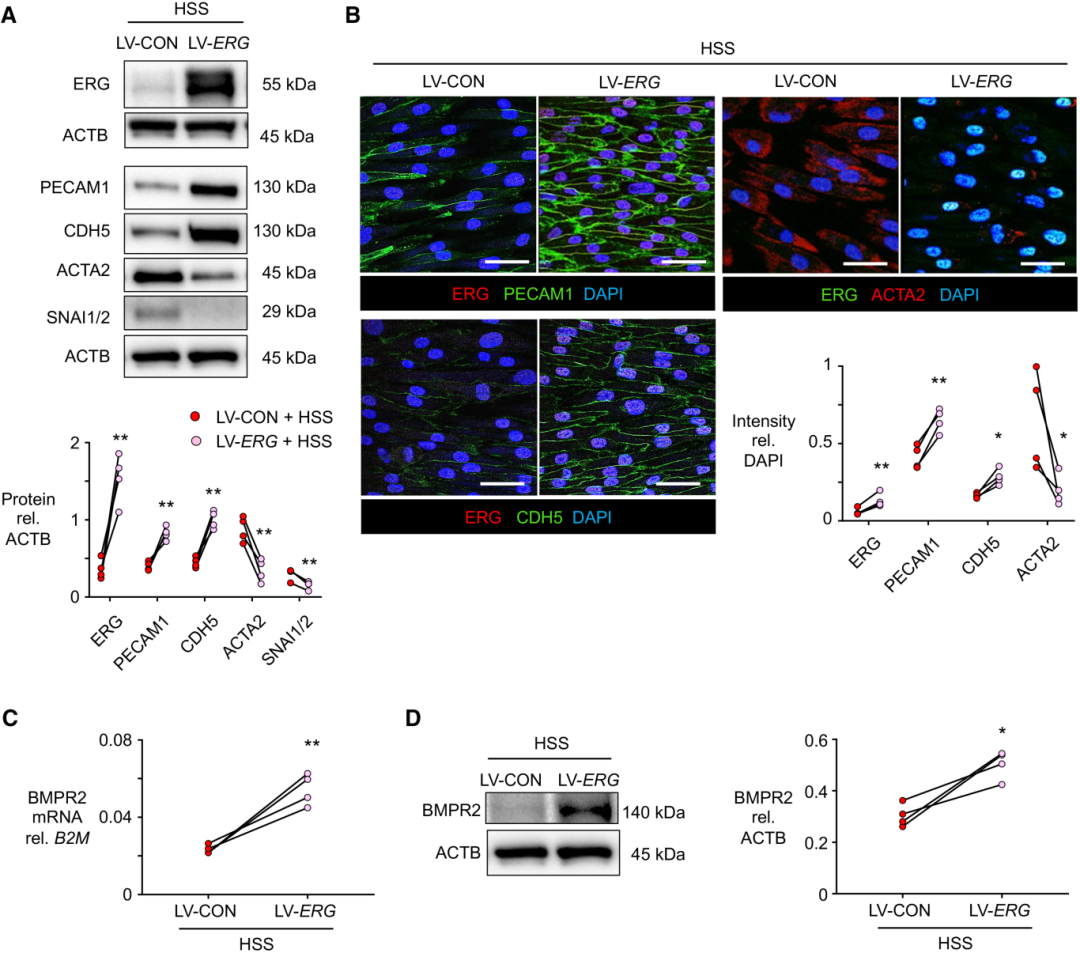
图2 补充 ERG(ETS 家族转录因子)可防止高剪切应力(HSS)下的内皮细胞间质转化 (EndMT)。
进一步地,研究人员将上述发现与小鼠动静脉分流术产生的 HSS 联系起来,并确定与肺血管变化相关的进行性 PAH 是否可能与 EndMT 相关及是否可能通过将 ERG 靶向肺 ECs 来抑制。利用带有肽标签 AAV2-ESGHGYF 的 AAV2 载体,选择性靶向肺 ECs,在进行假手术或动静脉分流术前1周注射用Erg或荧光素酶载体包裹的AAV2-ESGHGYF。结果表明,这种动静脉分流术在放置长达 8 周进行评估时会导致小鼠进行性 PAH。此外,假手术小鼠的腹部超声成像显示,下腔静脉呈均匀颜色(红色或蓝色)信号,表明层流,而动静脉分流的小鼠在扩大的下腔静脉中显示马赛克颜色图案,表明腹主动脉的血流受到干扰。这说明,动静脉分流术引起的病理性HSS会诱发PAH。
磁共振成像确定,与动静脉分流术一致,与假手术相比,两个心室和下腔静脉的尺寸均有所增加,Erg载体的构建对这一特征没有影响。动静脉分流术后 8 周,下腔静脉 CO(图3 A)和Po2(图3 B)的升高也不受 Erg 载体的影响。所有组的主动脉收缩压相似(图3 C)。
心导管检查显示,假手术小鼠的RVSP(右心室收缩压)在AAV-Erg处理前后无明显差异。通过RVSP升高判断,动静脉分流术小鼠与假手术小鼠相比,显示 PAH(37.2±1.0 vs 21.9±0.6 mm Hg)与先前在该模型中8周的发现一致。AAV-Erg 处理 导致RVSP变化降低50% 至29.2±0.8(图3 D)。与假手术AAV-Erg小鼠相比,AAV-Erg动静脉分流组的LVEDP(左心室舒张末压)升高,但与用AAV-Con载体处理的动静脉分流小鼠相比,LVEDP没有升高(图3 E)。此外,与AAV-Con载体相比,用AAV-Erg处理的动静脉分流小鼠的PVR降低(图3 F)。
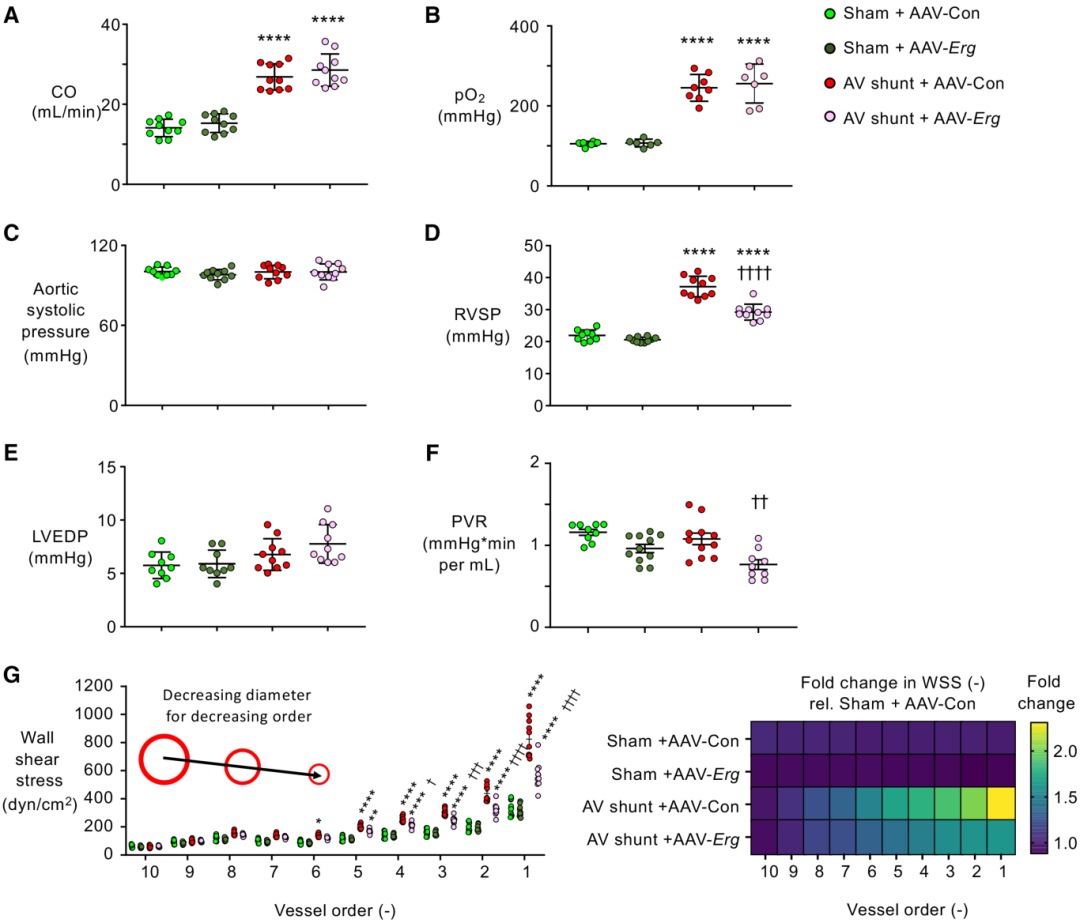
图3 通过补充肺动脉内皮细胞(PAEC) ERG (ETS家族转录因子)可减轻小鼠主动脉腔静脉(AV)分流诱导的肺动脉高压(PAH)。
最后,为了确定补充ERG对驱动EC表型变化的机械生物学刺激的影响,模拟每组小鼠PA树中的WSS(壁剪应力)。在比较PA树的各级时,WSS在所有组中随血管尺寸减小而增加(图3 G)。在PA分级的1至5级,对应直径<100µm的血管,与AAV-Con载体治疗的假手术组相比,AAV-Con载体治疗的动静脉分流术的WSS显著增加。与AAV-Con载体相比,用AAV-Erg处理的动静脉分流小鼠中PA 1至3级的WSS值较低,尽管它们仍然高于假手术小鼠(图3 G)。在PA 4至5级中,用AAV-Erg处理的动静脉分流小鼠的WSS值与对照组没有区别。
与RVSP的增加一致,动静脉分流的小鼠显示出RV重量与体重的增加,而AAV-Erg治疗的小鼠则减少(图4 A)。与假手术小鼠相比,动静脉分流小鼠的LV+S/体重比值同样增加。因此,用AAV-Con处理的动静脉分流动物的RV/LV + S重量比(右心室/左心室+室间隔)升高,但在给予AAV-Erg的动静脉分流小鼠中没有升高(图4 A)。在用AAV-Con或AAV-Erg处理的假手术小鼠中,RV或LV + S/体重比或RV / LV + S的重量比没有差异。
正如RVSP升高所预期的那样,通过ACTA2染色判断,具有动静脉分流的小鼠在肺泡管和壁水平的远端PAs肌肉化增加(图4 B、C),以及通过tdTomato(标记EC)和ACTA2染色阳性的细胞来判断EndMT的特征。与AAV-Con载体相比,AAV-Erg处理动静脉分流小鼠的远端动脉的肌肉化和EndMT均减少(图4 D、E)。用 AAV-Erg 载体处理的小鼠的假手术肺中,蛋白质免疫印迹预计 ERG 和 CDH5 会增加。此外,在用AAV-Con载体治疗的动静脉分流小鼠中观察到的ERG、CDH5和BMPR2的减少通过AAV-Erg载体治疗消除,其值与用AAV-Con载体治疗的假手术小鼠中观察到的值相似(图4 F)。这些数据表明,在动静脉分流小鼠中补充PAEC ERG可防止EndMT并减轻PAH。
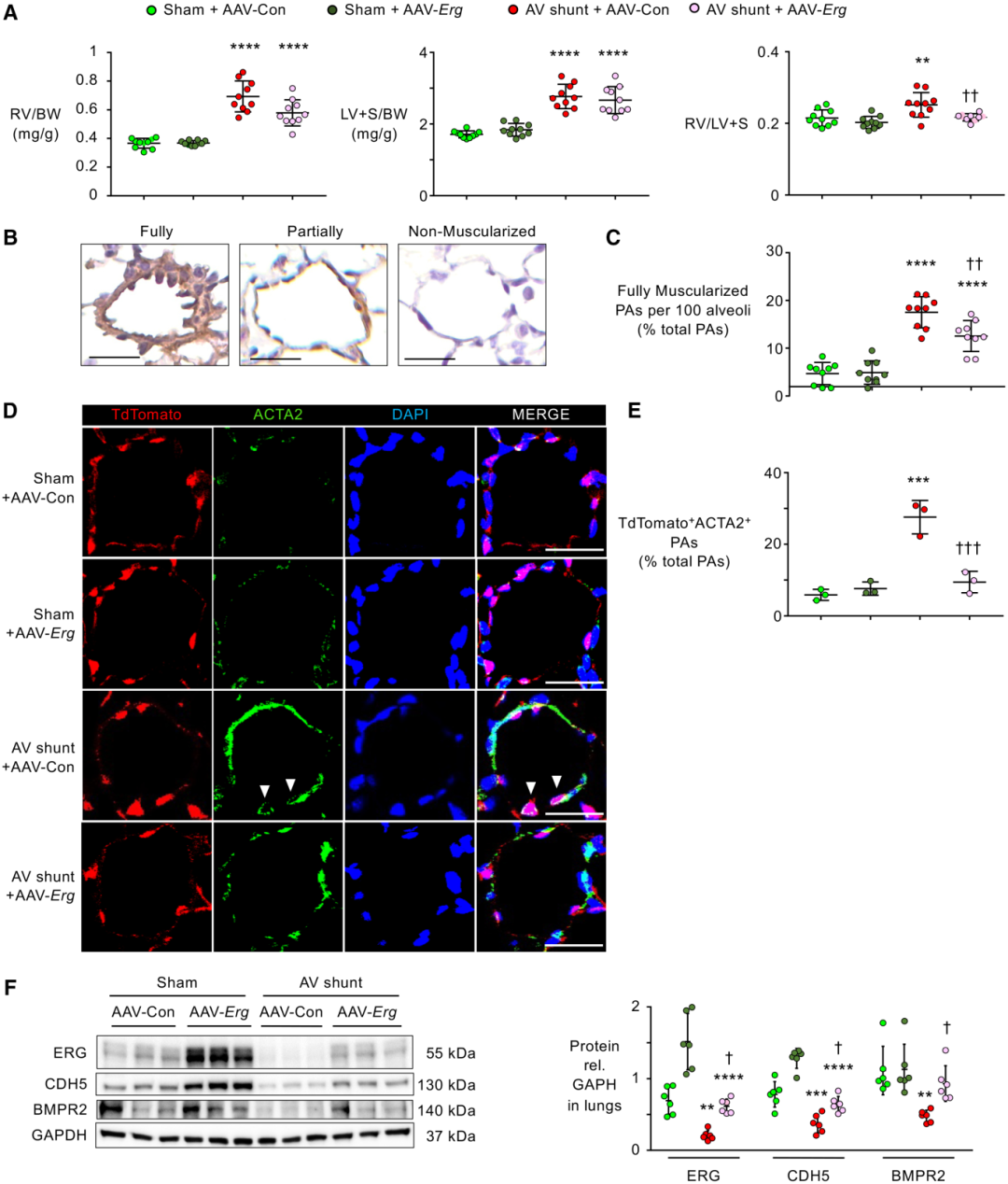
图4 小鼠主动脉腔静脉(AV)分流可诱导远端肺动脉(PAs)的内皮-间充质转化(EndMT)和重塑,这是通过肺动脉内皮细胞(PAECs)中Erg (ETS家族转录因子)的过度表达来挽救的。

图5 图形概要
HSS 导致 EndMT 的分子和形态学特征,包括内皮标志物的丢失以及 BMPR2 的丢失和平滑肌细胞标志物的增加。研究将这与ERG的缺失联系起来,方法是在LSS下减少ERG并重现EndMT,或在HSS下补充ERG并逆转EndMT;然后在带有动静脉分流的小鼠中概括了 EndMT 和进行性 PAH,并表明可以通过使用选择性靶向肺 ECs 的载体补充 ERG 来减轻这种反应。总之,这项研究揭示,病理HSS降低肺EC ERG,导致EndMT和PAH。上调 ERG 的药物可以逆转 HSS 介导的 PAH 和由高血流量或狭窄的 PA 引起的闭塞性血管重塑。
参考文献:Shinohara T, Moonen JR, Chun YH, Lee-Yow YC, Okamura K, Szafron JM, Kaplan J, Cao A, Wang L, Guntur D, Taylor S, Isobe S, Dong M, Yang W, Guo K, Franco BD, Pacharinsak C, Pisani LJ, Saitoh S, Mitani Y, Marsden AL, Engreitz JM, Körbelin J, Rabinovitch M. High Shear Stress Reduces ERG Causing Endothelial-Mesenchymal Transition and Pulmonary Arterial Hypertension. Arterioscler Thromb Vasc Biol. 2025 Feb;45(2):218-237. doi: 10.1161/ATVBAHA.124.321092. Epub 2024 Dec 26. PMID: 39723537; PMCID: PMC11753934.
原文链接:https://pubmed.ncbi.nlm.nih.gov/39723537/
图片来源:所有图片均来源于参考文献
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!进入官网www.naturethink.com或关注“Naturethink”公众号,了解更多相关内容。
点击了解:仿生流体剪切应力系统

