细胞铁死亡的发生原因及调控机制
2025-12-15 来源:本站 点击次数:49铁死亡主要是细胞内脂质活性氧生成与降解的平衡失调所致。当细胞抗氧化能力降低,脂质活性氧堆积,就能引起细胞氧化性死亡,即铁死亡。铁死亡可以被多种化合物所诱导,虽然其发生的信号通路不同,但是上游通路最终都是通过直接或间接影响谷胱甘肽过氧化物酶 (glutathione peroxidase,GPXs)的活性,降低细胞抗氧化能力,致使脂质过氧化反应增加,脂质活性氧增多,引起铁死亡的发生。
1. 通过抑制胱氨酸谷氨酸转运受体 (systemXC-)诱导铁死亡
胱氨酸/谷氨酸反向转运体( cystine/glutamate transporter,System Xc-) 是细胞内重要的抗氧化体系,由 SLC7A11 和SLC3A2L 两个亚单位组成,可以摄取胱氨酸( cystine,Cys) 和排出谷氨酸( glutamate,Glu) 。Cys被System Xc-摄取后还原为半胱氨酸,参与谷胱甘肽( glutathione,GSH)合成。GSH可在GSH过氧化物酶( glutathione peroxidase,GPX)的作用下还原活性氧和活性氮,因此抑制GSH合成,将导致细胞氧化损伤甚至铁死亡。
胱氨酸/谷氨酸反向转运体( cystine/glutamate transporter,System Xc-) 是细胞内重要的抗氧化体系,由 SLC7A11 和SLC3A2L 两个亚单位组成,可以摄取胱氨酸( cystine,Cys) 和排出谷氨酸( glutamate,Glu) 。Cys被System Xc-摄取后还原为半胱氨酸,参与谷胱甘肽( glutathione,GSH)合成。GSH可在GSH过氧化物酶( glutathione peroxidase,GPX)的作用下还原活性氧和活性氮,因此抑制GSH合成,将导致细胞氧化损伤甚至铁死亡。
2.直接抑制 GPX4诱导的铁死亡
GPXs家族有许多成员,其中GPX4在铁死亡中扮演着更加重要的角色。铁死亡诱导剂RSL3诱导BJeLR细胞发生死亡时,发现谷胱甘肽水平未受影响。用荧光素标记的RSL3处理 BJeLR细胞后再进行筛选,发现GPX4是RSL3的靶蛋白。另外,其他的一些化合物,如DPI7、DPI10等,同样能够直接作用于GPX4。GPX4是脂质过氧化过程的抑制蛋白,它能够降解小分子过氧化物以及相对复杂的脂质过氧化物。RSL3、DPI7和 DPI10等,能够直接作用于GPX4,抑制其活性,致细胞抗氧化能力下降,脂质活性氧上升,最终引起铁死亡。此外,甲羟戊酸通路(mevalonate path,MVA通路)可通过调节硒代半胱氨酸 tRNA的成熟而作用于GPX4,引起细胞的铁死亡。
GPXs家族有许多成员,其中GPX4在铁死亡中扮演着更加重要的角色。铁死亡诱导剂RSL3诱导BJeLR细胞发生死亡时,发现谷胱甘肽水平未受影响。用荧光素标记的RSL3处理 BJeLR细胞后再进行筛选,发现GPX4是RSL3的靶蛋白。另外,其他的一些化合物,如DPI7、DPI10等,同样能够直接作用于GPX4。GPX4是脂质过氧化过程的抑制蛋白,它能够降解小分子过氧化物以及相对复杂的脂质过氧化物。RSL3、DPI7和 DPI10等,能够直接作用于GPX4,抑制其活性,致细胞抗氧化能力下降,脂质活性氧上升,最终引起铁死亡。此外,甲羟戊酸通路(mevalonate path,MVA通路)可通过调节硒代半胱氨酸 tRNA的成熟而作用于GPX4,引起细胞的铁死亡。
3.p53介导的铁死亡
p53基因是重要的抑癌基因,其介导的细胞周期抑制、衰老、凋亡在肿瘤的发生发展过程中有重要作用。用 ROS处理 p53基因沉默的H1299细胞,细胞活性没有变化,但激活p53基因后再用ROS处理,细胞死亡率高达90%,说明p53基因激活后细胞抗氧化能力显著降低。再向其加入铁死亡抑制剂 ferrostatin-1后,细胞死亡率下降约 40%,从而发现 p53不仅可以引起细胞凋亡,也能诱导细胞铁死亡。上调 p53基因表达后,SLC7A11的信使RNA和蛋白表达量显著降低,从而证实SLC7A11为p53基因的新靶点。而systemXC-正是由SLC7A11和 SLC3A2组成的异二聚体。因此,p53可通过下调 SLC7A11的表达从而抑制 systemXC-吸收胱氨酸,致使胱氨酸依赖的谷胱甘肽过氧化物酶活性降低,细胞抗氧化能力降低,脂质活性氧升高,引起细胞铁死亡。
p53基因是重要的抑癌基因,其介导的细胞周期抑制、衰老、凋亡在肿瘤的发生发展过程中有重要作用。用 ROS处理 p53基因沉默的H1299细胞,细胞活性没有变化,但激活p53基因后再用ROS处理,细胞死亡率高达90%,说明p53基因激活后细胞抗氧化能力显著降低。再向其加入铁死亡抑制剂 ferrostatin-1后,细胞死亡率下降约 40%,从而发现 p53不仅可以引起细胞凋亡,也能诱导细胞铁死亡。上调 p53基因表达后,SLC7A11的信使RNA和蛋白表达量显著降低,从而证实SLC7A11为p53基因的新靶点。而systemXC-正是由SLC7A11和 SLC3A2组成的异二聚体。因此,p53可通过下调 SLC7A11的表达从而抑制 systemXC-吸收胱氨酸,致使胱氨酸依赖的谷胱甘肽过氧化物酶活性降低,细胞抗氧化能力降低,脂质活性氧升高,引起细胞铁死亡。
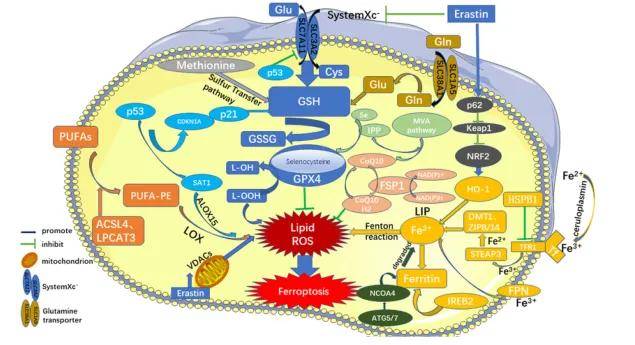
铁死亡的调控途径(Jie L,et al. Cell Death and Disease,2020)
相关文章
更多 >

