动脉粥样硬化进展的关键调节因子及调控机制研究
2026-01-12 来源:本站 点击次数:164动脉粥样硬化是一种慢性炎症性疾病,是全球心血管疾病死亡的主要原因。单核细胞活化和单核细胞来源的巨噬细胞渗入血管壁是动脉粥样硬化的中心环节。然而,这些过程背后的机制仍不清楚。上海市第六人民医院胡承、严婧团队与华中科技大学同济医学院附属协和医院程翔团队合作在PNAS(IF 9.1)上发表了题为“Myeloid GPSM1 regulates atherosclerosis progression by governing monocyte and macrophage activation and chemotaxis”的研究论文。本研究结果表明,GPSM1是动脉粥样硬化发展的调节因子,靶向GPSM1可能是一种有前途的抗动脉粥样硬化治疗方法。
· 维真助力 - AAV-PCSK9·
注射方式:尾静脉注射
注射剂量:2×10^11particles
造模方法:喂食西方饮食(D12108C)16周
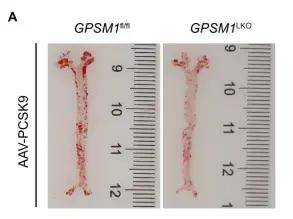
GPSM1缺失减轻了AAV-PCSK9诱导的动脉粥样硬化
研究结果
1、髓系特异性GPSM1表达与动脉粥样硬化发病密切相关
作者发现动脉粥样硬化导致巨噬细胞中GPSM1水平的增加,GPSM1可能参与了动脉粥样硬化的形成。接下来,探究了髓系GPSM1在动脉粥样硬化形成中的作用。作者构建了Apoe−/−背景的髓系GPSM1特异性敲除小鼠GPSM1LKOApoe−/−,并喂食WD16周。结果表明,相比于对照,GPSM1缺失抑制了小鼠主动脉的动脉粥样硬化病变;此外,GPSM1LKOApoe−/−小鼠显示出较少的巨噬细胞,表明髓系GPSM1缺失抑制了单核细胞的渗透能力。此外接受 AAV-PCSK9 注射的髓 GPSM1缺失小鼠表现出与Apoe−/− 背景小鼠相似的抗动脉粥样硬化和抗炎表型。表明髓系GPSM1缺失在预防动脉粥样硬化中的重要作用。反之,GPSM1过表达则加剧了动脉粥样硬化进展。
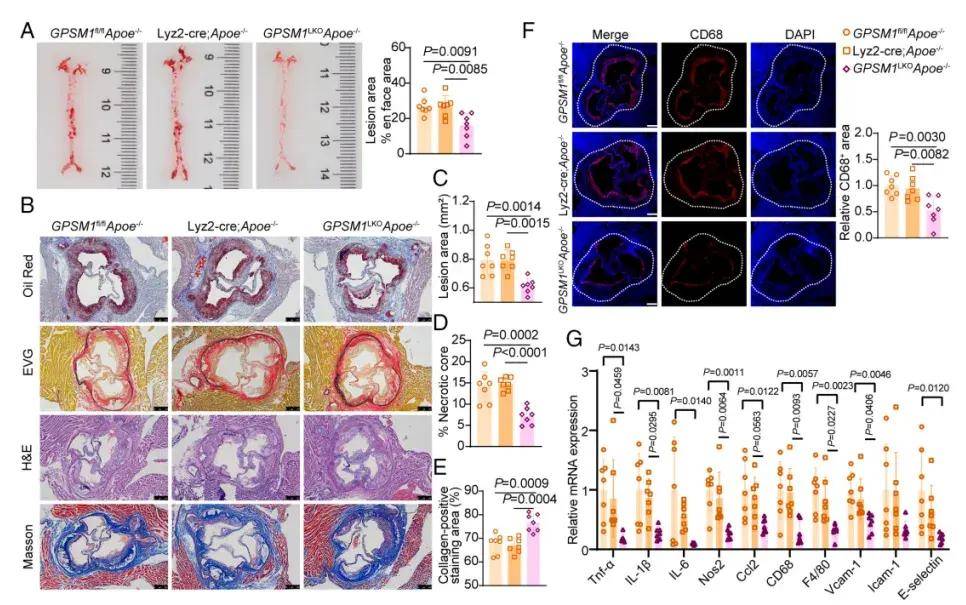 图1. 髓系特异性GPSM1缺失可保护保护小鼠免受动脉粥样硬化
图1. 髓系特异性GPSM1缺失可保护保护小鼠免受动脉粥样硬化
2、髓系GPSM1缺乏抑制单核细胞活化和单核细胞来源的巨噬细胞募集、趋化和黏附
作者进一步探究了体内单核细胞和巨噬细胞的趋化活性,主动脉根部切片分析显示,与对照组相比,GPSM1LKOApoe−/−小鼠来源的单核细胞对动脉粥样硬化斑块的募集显著减少;流式细胞仪分析表明,GPSM1缺失抑制了单核细胞对动脉的趋化作用。接下来,验证了GPSM1在体外对巨噬细胞趋化的诱导作用,发现缺乏GPSM1的THP-1细胞对CCL2的趋化活性显著降低。与野生型巨噬细胞相比,GPSM1缺乏的巨噬细胞的迁移能力较差。进一步探究GPSM1在单核细胞黏附中的作用,发现GPSM1缺乏使HAECs的单核细胞黏附数量显著减少,提示GPSM1对HAECs的趋化功能和黏附功能均有调节作用。这些结果提示髓系GPSM1缺失对动脉粥样硬化的保护作用,可能是降低了单核细胞-内皮细胞黏附和单核细胞来源的巨噬细胞聚集到动脉粥样硬化斑块。机制研究表明,GPSM1缺失通过cAMP/PKA/KLF4/PMP22轴以下调下游的p38/ERK MAPK通路,进而调控动脉粥样硬化进展。
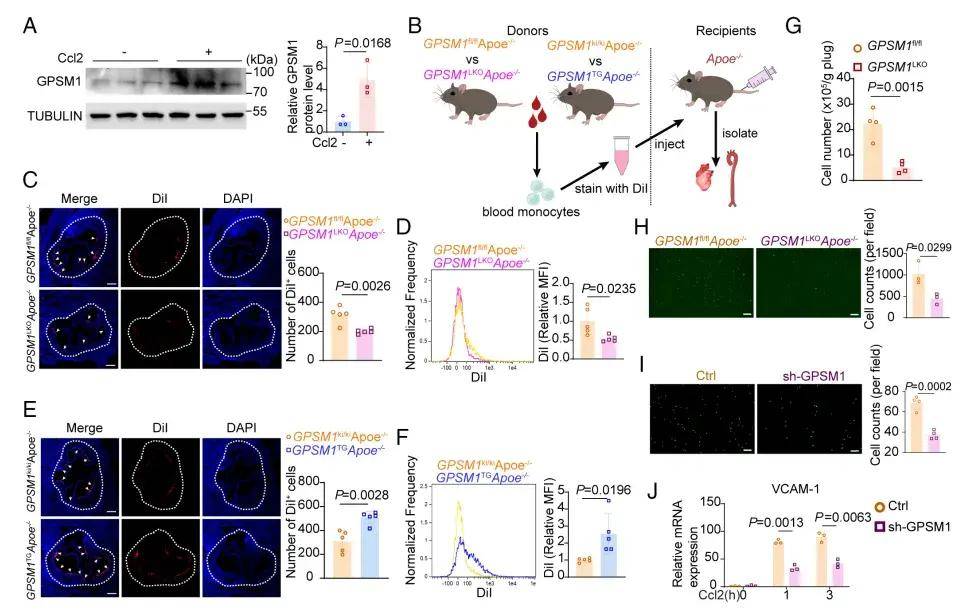 图2. 髓系GPSM1缺乏抑制单核细胞活化和单核细胞来源的巨噬细胞募集、趋化和黏附
图2. 髓系GPSM1缺乏抑制单核细胞活化和单核细胞来源的巨噬细胞募集、趋化和黏附
3、抑制GPSM1功能可延缓动脉粥样硬化的形成
作者先前研究发现小分子化合物AN-465/42243987能够对抗GPSM1在巨噬细胞中的促炎功能,在此验证GPSM1抑制剂是否可以治疗动脉粥样硬化的形成。与对照组相比,AN-465/42243987治疗显著减少了主动脉正面和主动脉根部的动脉粥样硬化斑块面积。与斑块稳定性改善一致,Masson三色染色显示治疗组病灶中胶原含量增加。此外,主动脉根部病变中CD68的免疫荧光染色显示,AN-465/42243987组斑块中CD68+巨噬细胞的浸润比对照组少。这些数据表明,小分子化合物AN-465/42243987可以通过减少巨噬细胞的渗透和增强斑块的稳定性来延缓动脉粥样硬化的进展,提示其对动脉粥样硬化具有潜在的治疗作用。
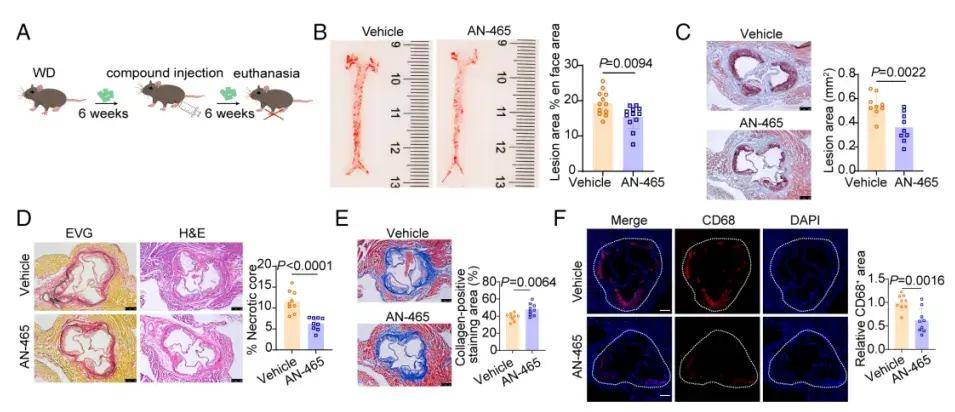 图3. 抑制GPSM1功能可预防动脉粥样硬化的形成
图3. 抑制GPSM1功能可预防动脉粥样硬化的形成
结论
本研究发现GPSM1通过控制单核细胞活化、巨噬细胞募集和黏附,是动脉粥样硬化进展的关键调节因子。GPSM1通过cAMP/PKA/KLF4轴调节PMP22和下游的MAPK途径,进而调控动脉粥样硬化进展,这些发现确立了GPSM1-PMP22轴是动脉粥样硬化斑块发展的关键驱动因素,并突出了其在动脉粥样硬化管理中的治疗潜力。

