CosMx SMI助力解析幽门螺杆菌相关胃癌中CAF介导的免疫调控机制
2026-01-19 来源:本站 点击次数:65
题目:Spatial and functional dissection of cancer-associated fibroblasts-mediated immune modulation in H. pylori-associated gastric cancer
期刊:Molecular Cancer
影响因子:33.9
DOI:10.1186/s12943-025-02490-9
研究背景
幽门螺杆菌(H. pylori)感染是全球胃癌发生的主要危险因素之一,尤其在东亚地区,其致癌贡献最为显著。传统观点认为,H. pylori主要通过长期炎症与黏膜损伤驱动胃癌发生;然而,随着对肿瘤微环境(TME)研究的深入,TME在H. pylori相关胃癌进展中的关键作用被逐渐意识到。
尽管这类胃癌通常伴随显著炎症反应,但其对免疫治疗却呈现普遍较低的应答率,提示其肿瘤微环境具有高度免疫抑制特征。越来越多的研究表明,癌相关成纤维细胞(CAF)可能是H. pylori感染后诱导免疫抑制的关键细胞成分,但其亚型构成、空间组织结构以及调控免疫细胞的具体机制仍缺乏系统性的解释。
基于这一背景,本研究利用高分辨率CosMx SMI空间分子成像技术,并结合单细胞测序数据,系统地描绘了H. pylori阳性胃癌中CAF的亚型组成、空间位置及其免疫调控网络,并进一步解析了导致免疫抑制微环境形成的关键分子轴及潜在干预靶点。
实验设计与技术手段
本研究以CosMx SMI空间分子成像技术为核心,采用980-plex及定制探针,在单细胞水平上对71例FFPE切片近千个基因进行原位检测,同时对组织切片的PanCK、CK8/18、CD45等关键蛋白进行染色,辅助细胞类型注释,并结合膜标记实现细胞分割,为后续解析CAF与免疫细胞的空间邻近关系及细胞互作提供了关键的数据基础。
此外,研究还整合了多个独立的单细胞转录组数据及LACE-seq技术,实现了多组学层面的互补验证与功能注释。
主要发现
1.肠型与弥漫型胃癌呈现不同的空间免疫状态
CosMx SMI空间分子成像显示,肠型胃癌(大多数与H. pylori长期感染相关)具有明确的肿瘤–基质边界,癌细胞形成紧密簇集,免疫细胞主要分布于肿瘤周边,形成典型的环状炎症细胞富集带,解释了为什么H. pylori相关胃癌虽然炎症严重,但免疫治疗效果却往往很差;而弥漫型胃癌中,癌细胞、成纤维细胞与免疫细胞呈广泛混杂,整体免疫信号传递显著减弱,表现出典型的免疫抑制特征。
 肠型vs弥漫型的空间结构差异
肠型vs弥漫型的空间结构差异2.CAF四大亚型呈现稳定的空间层级分布
研究将CAF明确分为炎症型(iCAF)、肌成纤维型(myCAF)、基质型(matCAF)和祖细胞型(proCAF)四类,并揭示了它们在组织中的层级式排列:
● iCAF最靠近癌细胞簇;
● myCAF、matCAF向外依次分布;
● proCAF 位于最外围的基质区域。
在H. pylori阳性胃癌中,CAF总体比例显著升高,各亚型的空间层级更加清晰,提示H. pylori感染在促使CAF在空间结构上发生系统性重塑。
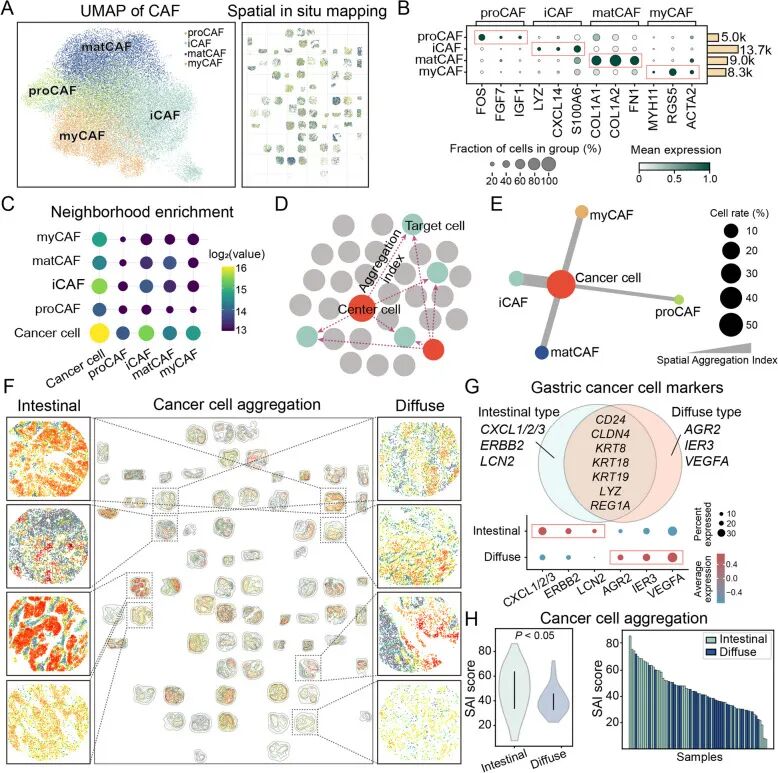 CAF四大亚型空间层级分布
CAF四大亚型空间层级分布3.H. pylori阳性胃癌中两条CAF介导的协同免疫抑制途径
研究还明确了两条关键的CAF调控通路:
①THBS1⁺ CAF→分泌WNT5–FZD→Treg的空间富集与功能维持:
CosMx SMI结果显示,THBS1高表达的matCAF与调节性T细胞(Treg)呈显著临近关系;细胞通讯分析进一步确认WNT5A/WNT5B–FZD5/FZD6是这类细胞互作的核心配体–受体对。该通路增强了Treg的稳态维持和免疫抑制作用。
②ZFP36高表达→降解FN1 mRNA→削弱CTL激活:
ZFP36能识别FN1 3′UTR中多个AUUUA基序,诱导mRNA降解,从而抑制FN1⁺ CAF的免疫激活功能,间接削弱细胞毒性T淋巴细胞(CTL)的杀伤能力。浆细胞标志基因(MZB1、IGHG1)富集,TLS面积与细胞密度更高。
两条轴分别增强Treg活性与削弱CTL功能,最终共同塑造了H. pylori阳性胃癌的局部免疫抑制微环境。
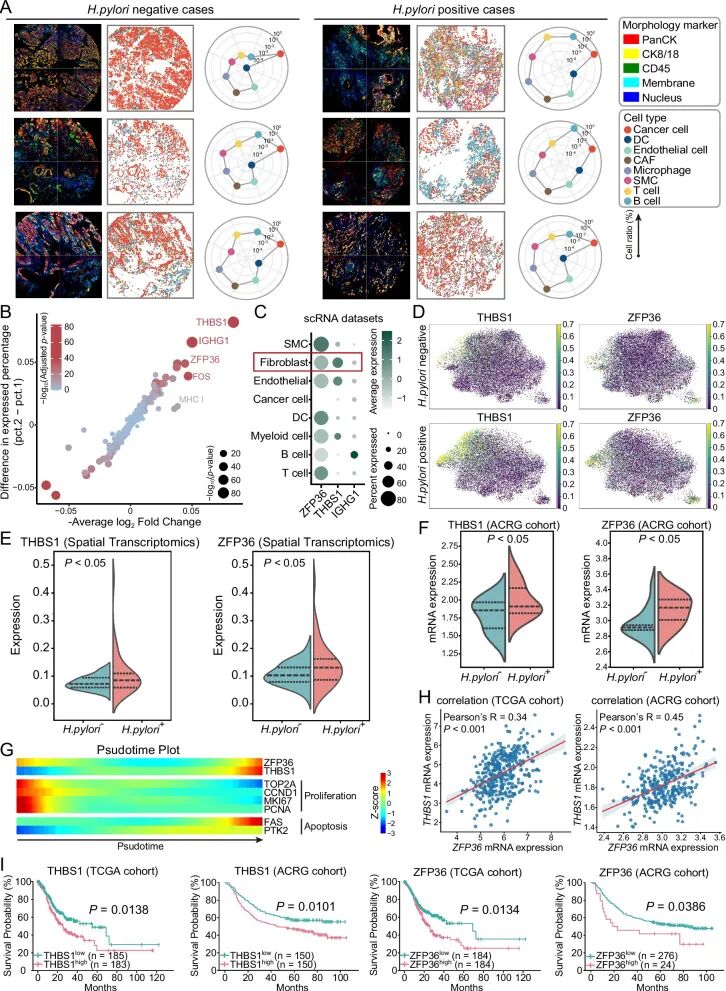 CAF介导的双轴免疫抑制通路
CAF介导的双轴免疫抑制通路4.关键分子与CAF–Treg空间特征与患者预后密切相关
研究继续在两个独立胃癌队列中进行验证,发现THBS1与ZFP36的高表达均与显著的不良预后相关。同时,CAF–Treg的空间聚合程度越高,患者总生存期越短。这些结果表明,CAF相关分子轴在塑造H. pylori阳性胃癌免疫抑制微环境的同时,也显著影响患者预后。
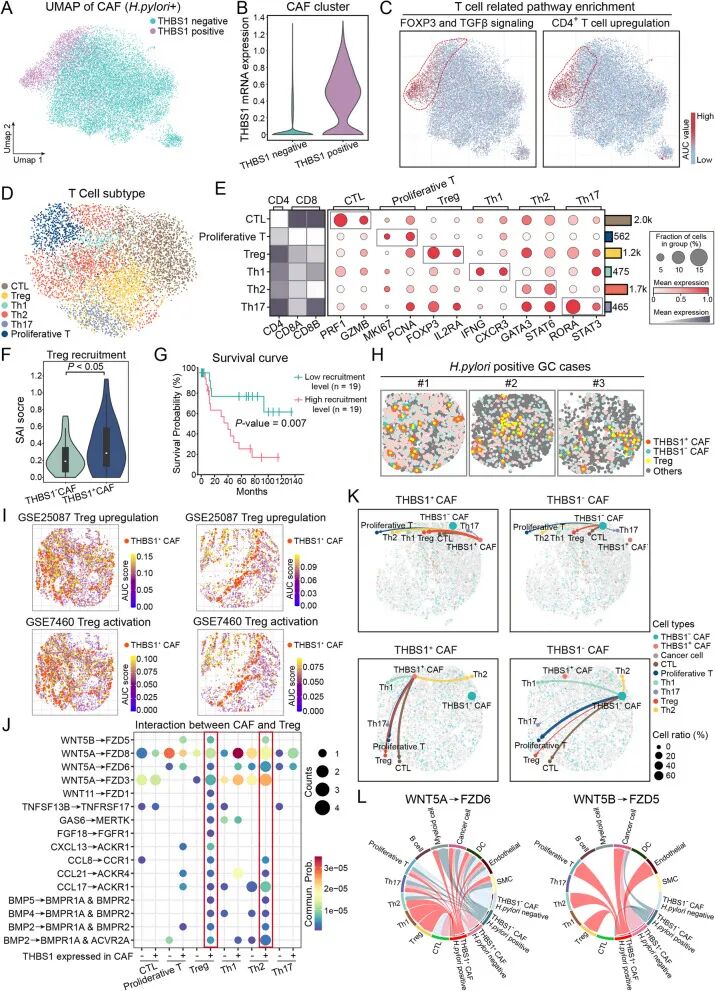 关键分子与CAF–Treg空间特征的预后意义
关键分子与CAF–Treg空间特征的预后意义文章总结
本研究利用CosMx SMI空间分子成像技术,对幽门螺杆菌(H. pylori)阳性胃癌的肿瘤微环境进行了深入解析,揭示了癌相关成纤维细胞(CAF)在免疫抑制中的关键调控作用。同时,研究还系统地识别了CAF的四大亚型(iCAF、myCAF、matCAF、proCAF)的层级式空间分布,并基于空间组学数据,明确了两条协同的免疫抑制轴,验证了CAF相关分子的空间特征和预后价值。该研究不仅揭示了H. pylori感染相关胃癌形成免疫抑制微环境的深层机制,也为东亚高发人群的精准治疗指明了新的方向,有望逆转这类胃癌的免疫抑制状态,从而改善患者对免疫治疗的响应。

