Cre-Lox系统核心原理全解析及体内Cre-lox系统的基础应用
2025-05-14 来源:本站 点击次数:2111. 什么是Cre-lox系统?
Cre-lox系统由Cre重组酶和loxp位点两部分组成。
Cre重组酶
Cre重组酶由噬菌体P1的环化重组酶基因产生的一个38 kDa的DNA重组酶,能特异性地识别Loxp位点,实现DNA片段的重组。除Cre以外,此类重组酶还有Flp(flipase)和Dre(D6特异性重组酶)。
Lox位点
lox位点是一个34bp的序列,由两个13bp的反向回文重复序列和8bp的中间间隔序列组成:ATAACTTCATGTA-NNNTANNN-TATACGAAGTTAT。N表示可变碱基,不同的碱基选择可形成不同的Lox位点,除了野生型loxP,常见的还有Lox2272,Lox511,Lox5171等,这些突变Lox位点也能被Cre重组酶识别,但只有两个序列相同的Lox位点之间才能发生重组。
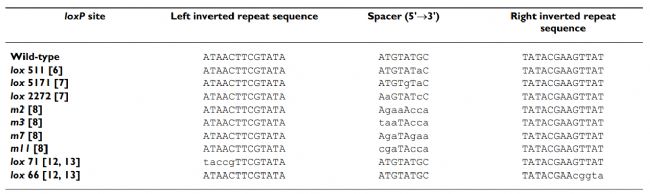
图1 . loxP位点及其突变体位点[1]
根据lox位点的排列方向和位置,Cre重组酶能介导片段发生删除、倒转和易位三种重组事件:
-
Deletion(删除):当两个Lox位点在同一染色体上且方向相同时,两个Lox位点之间的序列将被删除。
-
Inversion(倒转):当两个Lox位点位于同一染色体上且方向相反时,两个Lox位点之间的序列将发生序列倒转。
-
Translocation(易位):当两个Lox位点位于不同的染色体上且方向相同,将导致2条染色体上DNA片段的交换。
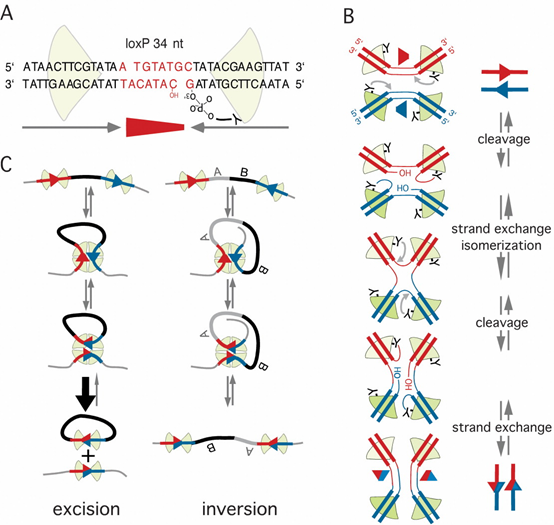
图2. Cre的重组机制[2]。A)loxP位点的基本结构。红色箭头指示loxP位点的方向。B)Cre-loxP介导的易位重组。C)左图示Cre介导两同向loxP位点间的切除重组。右图示Cre介导两反向loxP位点间的反转重组。
2. 体内Cre-lox系统的基础应用
利用Cre-lox系统在小鼠体内实现对基因的时空特异性打靶(表达或敲除),原则上需要建立两种小鼠。
一是Cre工具鼠,该小鼠为携带Cre重组酶的基因修饰小鼠。其中,Cre重组酶由特定启动子驱动,可在特定细胞或组织中表达;二是Flox小鼠,即在靶基因序列两侧插入Lox位点的基因修饰小鼠。通过将上述两种小鼠交配繁育,即可获得基因条件性敲除或过表达小鼠。
2.1 基因条件性表达
在基因条件性表达中,Flox小鼠的靶基因与启动子之间通常插入了一个“终止盒”(lox-stop-lox-GENE)。该元件能阻止靶基因的转录和表达。将Flox小鼠与细胞类型特异性表达Cre的工具鼠交配所获得的子代小鼠中,所有表达Cre重组酶的细胞,stop元件会被删除。因此,靶基因仅在这些特定细胞中得以表达。

图3. 条件性基因表达小鼠原理示意图[3]
2.2 基因条件性敲除
在基因条件性表达中,Flox小鼠一般在需要删除的DNA片段两侧带有同方向的两个Lox位点(lox-GENE-lox)。将Flox小鼠与细胞类型特异性Cre小鼠交配所获得的子代小鼠中,所有表达Cre重组酶的细胞,该DNA片段会被删除。
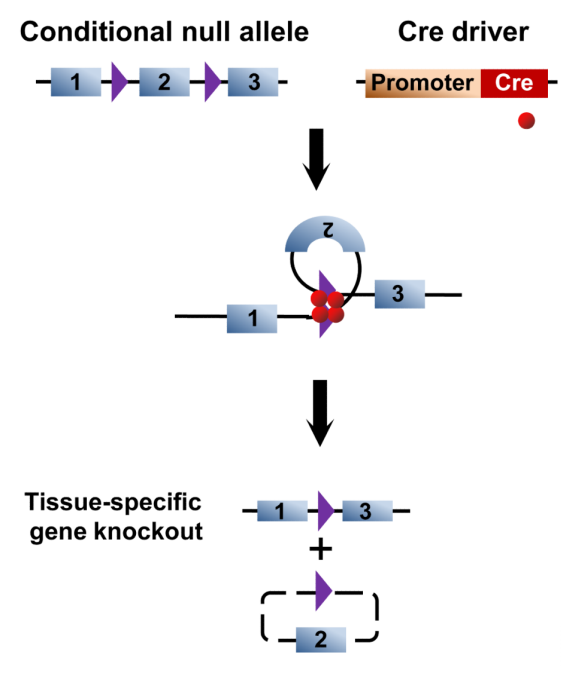
图4. 条件性基因敲除小鼠原理示意图[3]
3. 更精准的诱导型Cre-lox系统
为更准确地进行遗传功能研究,时间特异性的Cre-lox(也叫诱导型Cre-lox)被开发出来,可用于研究生物体发育过程特定阶段的基因功能,或用来进行谱系示踪等。常用诱导型Cre-lox系统有:
3.1 CreER系统
通过他莫昔芬(Tam)诱导Cre酶的重组活性。在没有他莫昔芬的情况下,CreER融合蛋白与热休克蛋白90(HSP90)相互作用并存在于细胞质中(图5.1)。给予他莫昔芬药物处理会破坏HSP90与CreER的相互作用(图5.2)。ER与Tam的相互作用诱导Cre的核易位(图5.3)。在细胞核中,CreER识别loxP位点(图5.4)并使组织X中的基因Y失活(图5.5)。CreERT2在体内对药物诱导的敏感性更高,因此一般优选使用CreERT2。
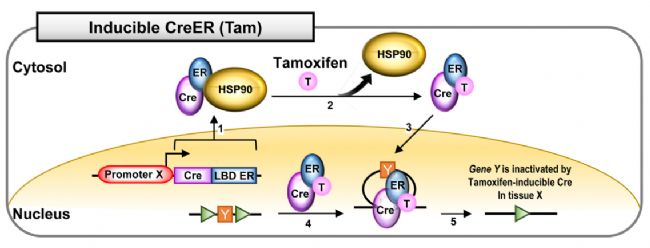
图5. 他莫昔芬(Tam)诱导的Cre系统[4]
3.2 Cre;Tet系统
四环素诱导系统,也叫强力霉素(Dox,四环素衍生物)诱导的Cre系统。该系统有两种模式:Tet-on和Tet-off,分别是Dox依赖性Cre的激活和Dox依赖性Cre的失活。Tet系统包括以下元件:反向四环素控制反式激活因子(rtTA);四环素控制反式激活因子(tTA);四环素响应元件(TRE),通常是19个核苷酸的四环素操纵子(tetO)序列的7个重复,调节Cre基因的表达。Dox通常在小鼠的饲料或饮水中进行给药。
Cre;Tet-on系统:Dox给药才能打开Cre表达。在Tet-on系统中,表达普遍存在的或组织特异性的启动子驱动的rtTA。在没有Dox的情况下,失活的rtTA无法与负责调控Cre基因的TRE序列结合,则Cre不表达。在Dox给药之后,Dox结合并激活rtTA。激活的rtTA与TRE序列结合并诱导Cre表达。
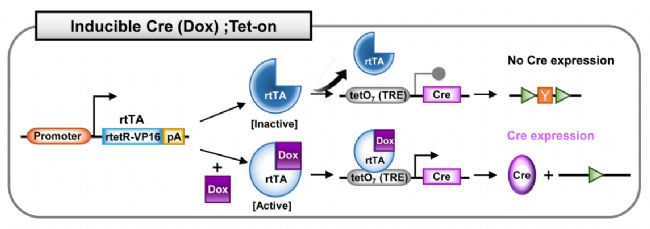
图6. Dox诱导的Cre;Tet-on系统[4]
Cre;Tet-off系统:Dox给药后关闭Cre表达。在Tet-off系统中,在没有Dox的情况下,激活的tTA能够结合Cre前的TRE序列并诱导Cre表达。而在Dox给药后,与Dox相互作用的tTA被灭活。灭活的rTA不再与TRE结合,因此Cre表达受到抑制。
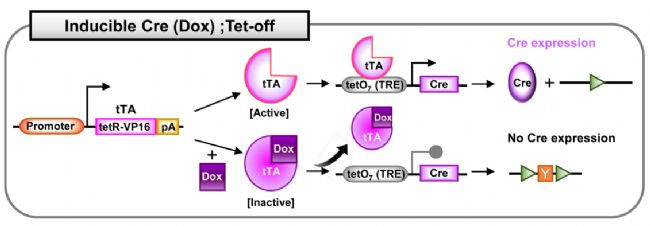
图7. Dox诱导的Cre;Tet-off系统[4]
4. 南模生物Cre/Dre工具鼠库
南模生物可提供超过600多种自主产权Cre/Dre工具鼠,覆盖全身各类型的细胞组织,满足科研人员多样化的需求。同时,我们还在对Cre/Dre工具鼠进行全面的验证,目前已经完成了200多种Cre/Dre工具鼠的验证工作。
为方便大家更快的找到自己想要的Cre工具鼠,我们还特别定制了Find Cre搜索系统:https://www.modelorg.com/findcre.html。Find Cre整个界面以小鼠组织、器官和系统为主线,可分为肺、肝、胃肠道、乳腺、胰腺、感觉器官、心血管系统、免疫系统、神经系统、泌尿生殖系统、骨骼肌系统以及其他组织器官。大家选择自己感兴趣的组织器官,就可以查看该组织下可用的Cre工具鼠啦,点击这里即可快速访问。
部分Cre品系验证数据如下:
1 Alb-CreERT2
Alb-CreERT2小鼠是研究肝脏基因功能与疾病的重要小鼠品系,验证数据证明Alb-CreERT2小鼠可以成为实现肝脏时间特异性敲除或表达的工具鼠。
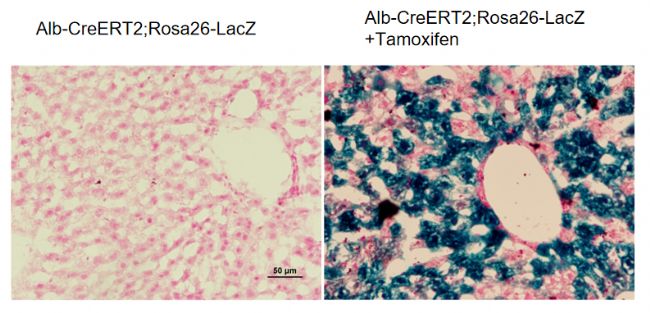
图8. Alb-CreERT2; Rosa26-LacZ小鼠肝组织X-gal染色。未使用他莫昔芬诱导的小鼠,肝细胞未被染色;使用他莫昔芬诱导的小鼠,肝细胞成功着色。
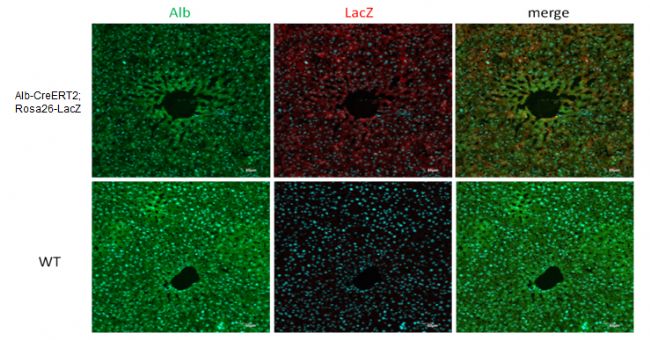
图9. Alb-CreERT2; Rosa26-LacZ小鼠肝组织免疫荧光检测。Alb-CreERT2; Rosa26-LacZ小鼠被他莫昔芬诱导后,LacZ(红色)表达。
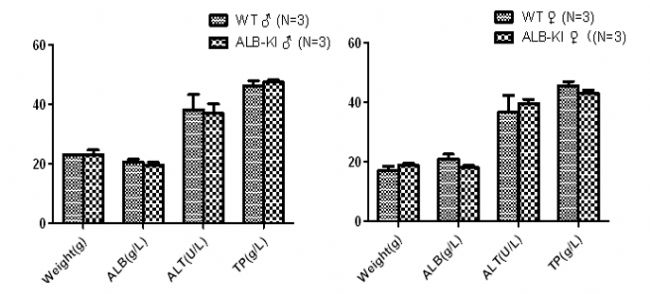
图10. Alb-CreERT2小鼠血生化检测。结果显示Alb-CreERT2小鼠与野生型小鼠相比肝功能正常。
2 Pvalb-Cre
Pvalb-Cre在中间神经元中表达iCre重组酶,而不干扰内源性Pvalb表达。这些小鼠可能对研究神经元分化有重要作用。
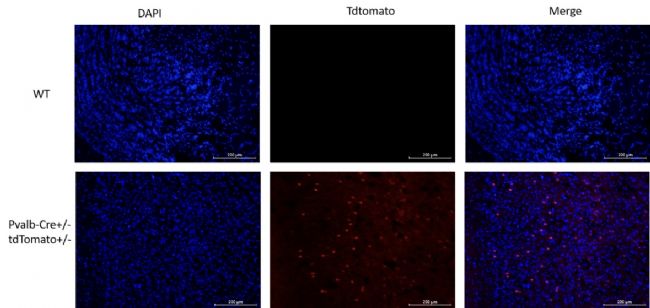
图11. 荧光检测PvalbCre+/-; Rosa26tdTomato+/-小鼠大脑皮层中间神经元tdTomato的表达。
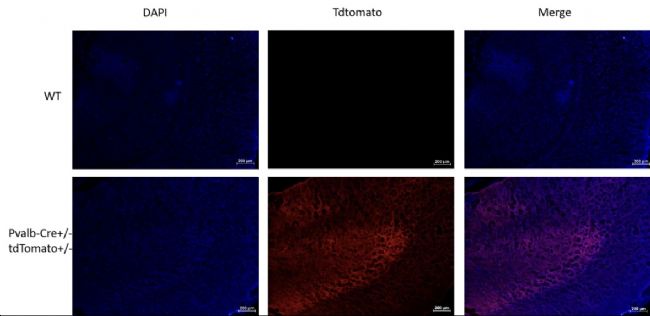
图12. 荧光检测PvalbCre+/-; Rosa26tdTomato+/-小鼠海马中间神经元tdTomato的表达。结果显示:双阳性小鼠海马中间神经元有tdTomato的表达,表达类型符合预期。
如您有相关需求,欢迎拨打400-728-0660或于微信公众号南模生物SMOC在线咨询,我们的专业团队将竭诚为您服务!
下一期我们将深入探讨Cre-lox系统的常见问题及饲养繁育技巧,感兴趣的朋友可关注下方微信公众号,即时获取专业指导与实用干货,加速您的研究进程!
References
- Missirlis PI, Smailus DE, Holt RA. Ahigh-throughput screen identifying sequence and promiscuity characteristics ofthe loxP spacer region in Cre-mediated recombination. BMC Genomics.2006;7:73. Published 2006 Apr 4. doi:10.1186/1471-2164-7-73
- Tronche F, Casanova E, Turiault M, Sahly I, Kellendonk C. When reversegenetics meets physiology: the use of site-specific recombinases in mice. FEBSLett. 2002;529(1):116‐121. doi:10.1016/s0014-5793(02)03266-0
- Magnuson M , Osipovich A . Pancreas-Specific Cre Driver Lines and Considerations for Their Prudent Use[J]. Cell Metabolism, 2013, 18(1):9-20.
- Kim H, Kim M, Im SK, Fang S.Mouse Cre-LoxP system: general principles to determine tissue-specific roles oftarget genes. Lab Anim Res. 2018;34(4):147‐159. doi:10.5625/lar.2018.34.4.147
- Song AJ, Palmiter RD. Detecting and Avoiding Problems When Using theCre-lox System. Trends Genet. 2018;34(5):333‐340.doi:10.1016/j.tig.2017.12.008
- Duffield JS, Humphreys BD. Origin of new cells in the adult kidney:results from genetic labeling techniques. Kidney Int.2011;79(5):494‐501. doi:10.1038/ki.2010.338
- Feil S, Valtcheva N, Feil R. Inducible Cre mice. Methods MolBiol. 2009;530:343‐363. doi:10.1007/978-1-59745-471-1_18
- Holzenberger M, Lenzner C, Leneuve P, et al. Cre-mediated germline mosaicism:a method allowing rapid generation of several alleles of a target gene. NucleicAcids Res. 2000;28(21):E92. doi:10.1093/nar/28.21.e92
- Becher B, Waisman A, Lu LF. ConditionalGene-Targeting in Mice: Problems and Solutions. Immunity. 2018;48(5):835‐836.doi:10.1016/j.immuni.2018.05.002
关于我们
上海南方模式生物科技股份有限公司(Shanghai Model Organisms Center, Inc.,简称"南模生物"),成立于2000年9月,是一家上交所科创板上市高科技生物公司(股票代码:688265),始终以编辑基因、解码生命为己任,专注于模式生物领域,打造了以基因修饰动物模型研发为核心,涵盖多物种模型构建、饲养繁育、表型分析、药物临床前评价等多个技术平台,致力于为全球高校、科研院所、制药企业等客户提供全方位、一体化的基因修饰动物模型产品解决方案。

