CosMx SMI技术助力揭示PD-1缺失增强Treg的免疫抑制机制
2025-08-28 来源:本站 点击次数:59
题目:PD-1 receptor deficiency enhances CD30⁺ Treg cell function in melanoma
期刊:Nature Immunology
IF:27.6
DOI:10.1038/s41590-025-02172-0
研究背景
免疫检查点抑制剂疗法(尤其是针对PD-1/PD-L1通路的抗体),已成为治疗晚期黑色素瘤的重要手段。然而,仍有约半数患者对治疗无明显反应。究其原因,免疫微环境中存在的免疫抑制机制被认为是可能的重要原因之一。
Treg细胞(调节性T细胞)作为免疫系统的重要调节者,在维持免疫耐受与限制过度免疫反应中起作用。同时,Treg细胞也可能抑制抗肿瘤免疫应答,在肿瘤微环境中发挥免疫抑制作用。虽然PD-1传统上被视为T细胞耗竭的标志,但在Treg细胞中,PD-1的功能长期被忽视。
本研究聚焦于PD-1在Treg细胞中的潜在作用,通过单细胞与空间转录组技术,揭示了PD-1缺失如何通过增强Treg细胞的免疫抑制功能、重塑肿瘤微环境,从而促进黑色素瘤进展,并提出了CD30作为潜在联合靶点的治疗新思路。
技术手段
研究团队在黑色素瘤动物模型基础上,利用基因编辑技术构建了多种免疫背景的小鼠模型,并采集肿瘤组织,进行单细胞和空间转录组测序。通过单细胞转录组测序,系统地刻画Treg细胞的功能状态、信号通路变化及谱系转变轨迹。为进一步揭示Treg细胞在组织中的空间分布与细胞互作,研究采用CosMx SMI空间转录组平台,基于肿瘤切片构建高分辨率的空间转录图谱,并结合FoxP3、Tnfrsf8等标志基因对Treg细胞及其他免疫细胞进行空间注释。配合细胞通讯分析和细胞轨迹分析,构建肿瘤组织内Treg细胞的空间分布图谱与细胞互作网络,为理解其调控机制提供高维数据支撑。
主要发现
1.PD-1缺失增强Treg功能,构建抑制性肿瘤微环境
本研究基于多种遗传背景的小鼠模型,系统地评估了PD-1缺失对Treg细胞功能的影响,Treg细胞在缺失PD-1后呈现出数量增多、FoxP3表达上调的特征,表现出更强的免疫抑制功能。在B16黑色素瘤模型中,PD-1缺失型 Treg细胞能够显著促进肿瘤生长,说明其在构建免疫抑制性肿瘤微环境(TME)中发挥了关键作用。通过Rag1⁻/⁻免疫缺陷小鼠模型进一步实验确认,该效应来源于Treg细胞本身,而非其他免疫细胞的间接影响。
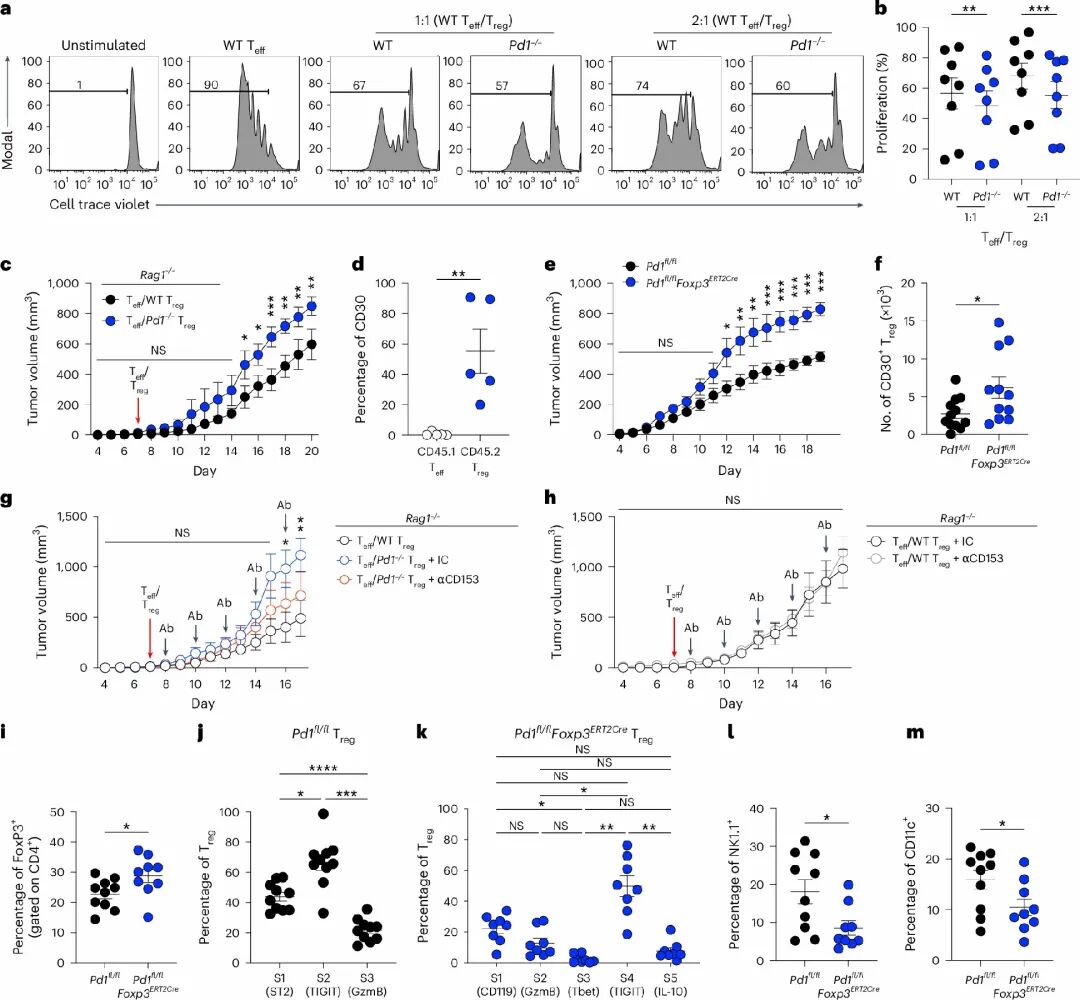 PD-1缺失增强Treg细胞免疫抑制功能
PD-1缺失增强Treg细胞免疫抑制功能2.CD30特异性上调,是Treg功能增强的核心驱动因子
结合单细胞和空间转录组数据,研究发现PD-1缺失Treg细胞中Tnfrsf8(编码CD30)的表达显著升高,区别于其他抑制分子如CTLA4、TIGIT等。CD30主要分布于肿瘤边缘及免疫抑制富集区域。功能验证实验显示,阻断CD30的配体CD153可有效削弱Treg细胞的免疫抑制作用,提示CD30信号轴在PD-1调控Treg细胞活性中占据中心地位。
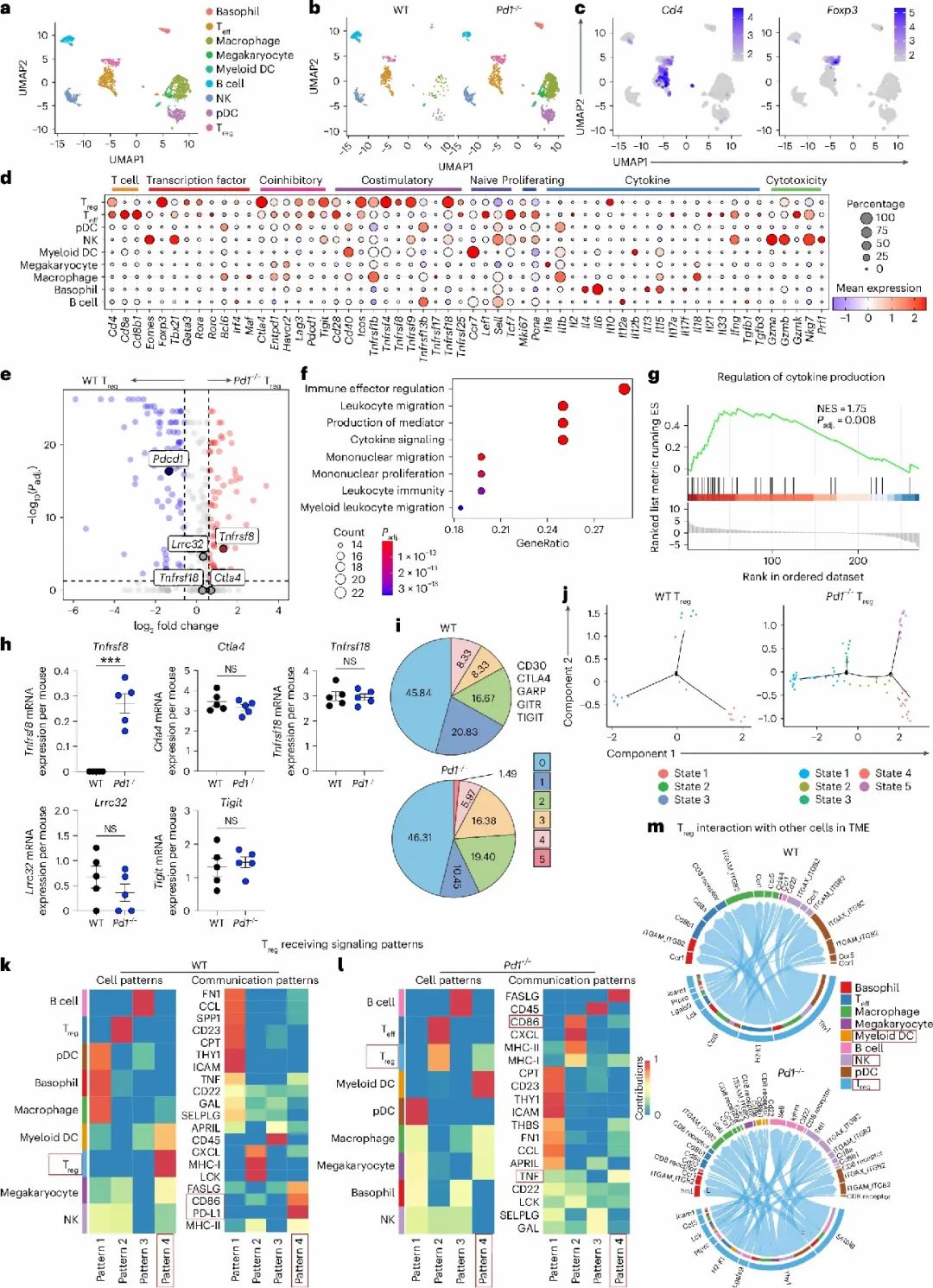 单细胞转录组揭示Pd1⁻/⁻ Treg细胞中CD30显著上调
单细胞转录组揭示Pd1⁻/⁻ Treg细胞中CD30显著上调3.STAT5信号激活CD30,构建PD-1–STAT5–CD30抑制通路
机制研究发现,PD-1缺失可增强IL-2依赖的STAT5磷酸化,促进其结合Tnfrsf8启动子,从而驱动CD30表达。STAT5缺失或抑制后,CD30表达明显下降,Treg细胞功能亦受损,形成一条完整的功能增强路径:PD-1缺失 → STAT5活化 → CD30上调 → Treg细胞免疫抑制增强,揭示PD-1在Treg细胞中的抑制机制。
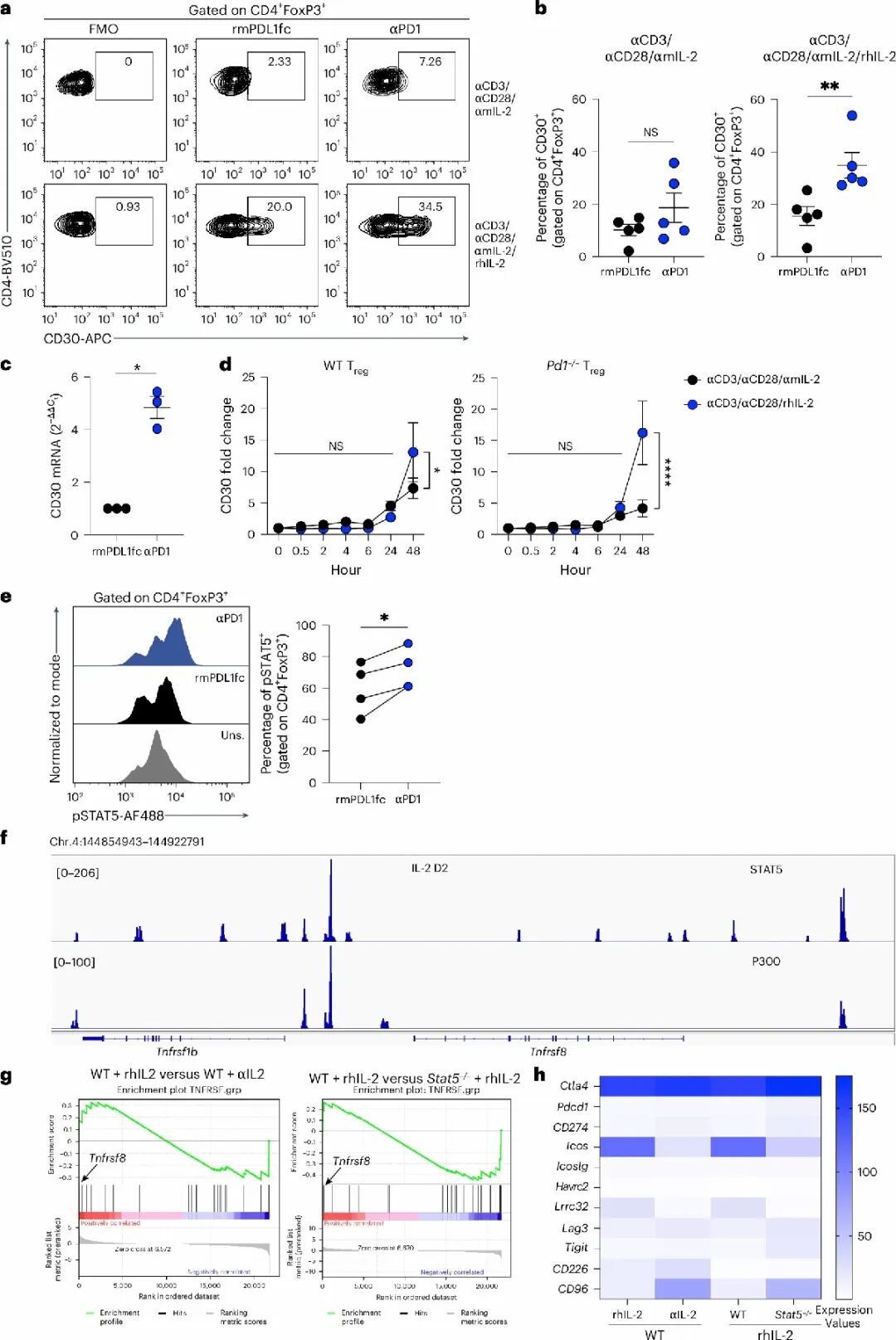 STAT5驱动CD30表达
STAT5驱动CD30表达4.空间组学描绘Treg主导的免疫微环境重塑
利用CosMx SMI空间转录组技术,研究进一步描绘了Treg细胞在组织中的空间分布与细胞互作关系。PD-1缺失Treg细胞富集于肿瘤边缘,与Spp1⁺巨噬细胞和Il10⁺树突细胞等免疫抑制亚群形成特定生态位。细胞通讯分析显示,Treg细胞与周围细胞形成了多条免疫调控通路。尽管在NK细胞与DC细胞中也观察到干扰素相关通路的转录上调,但蛋白水平未表现出一致变化,提示空间免疫信号可能存在转录后调控机制或功能延迟。
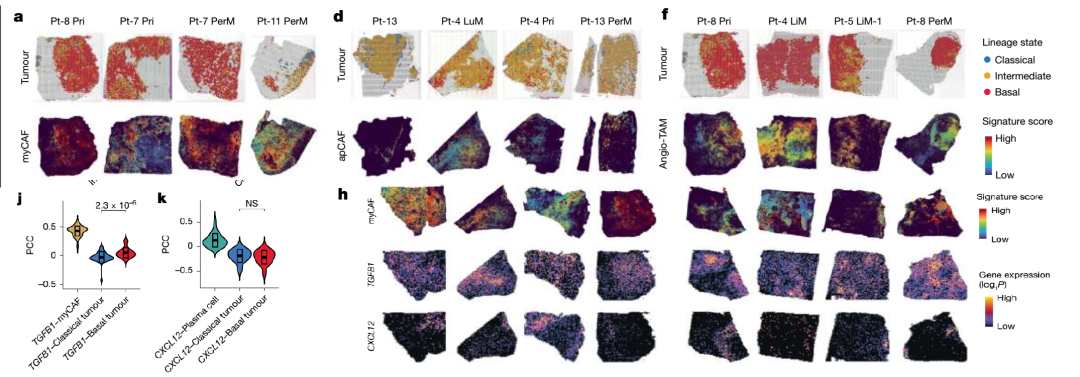 PDAC肿瘤点在基础谱
PDAC肿瘤点在基础谱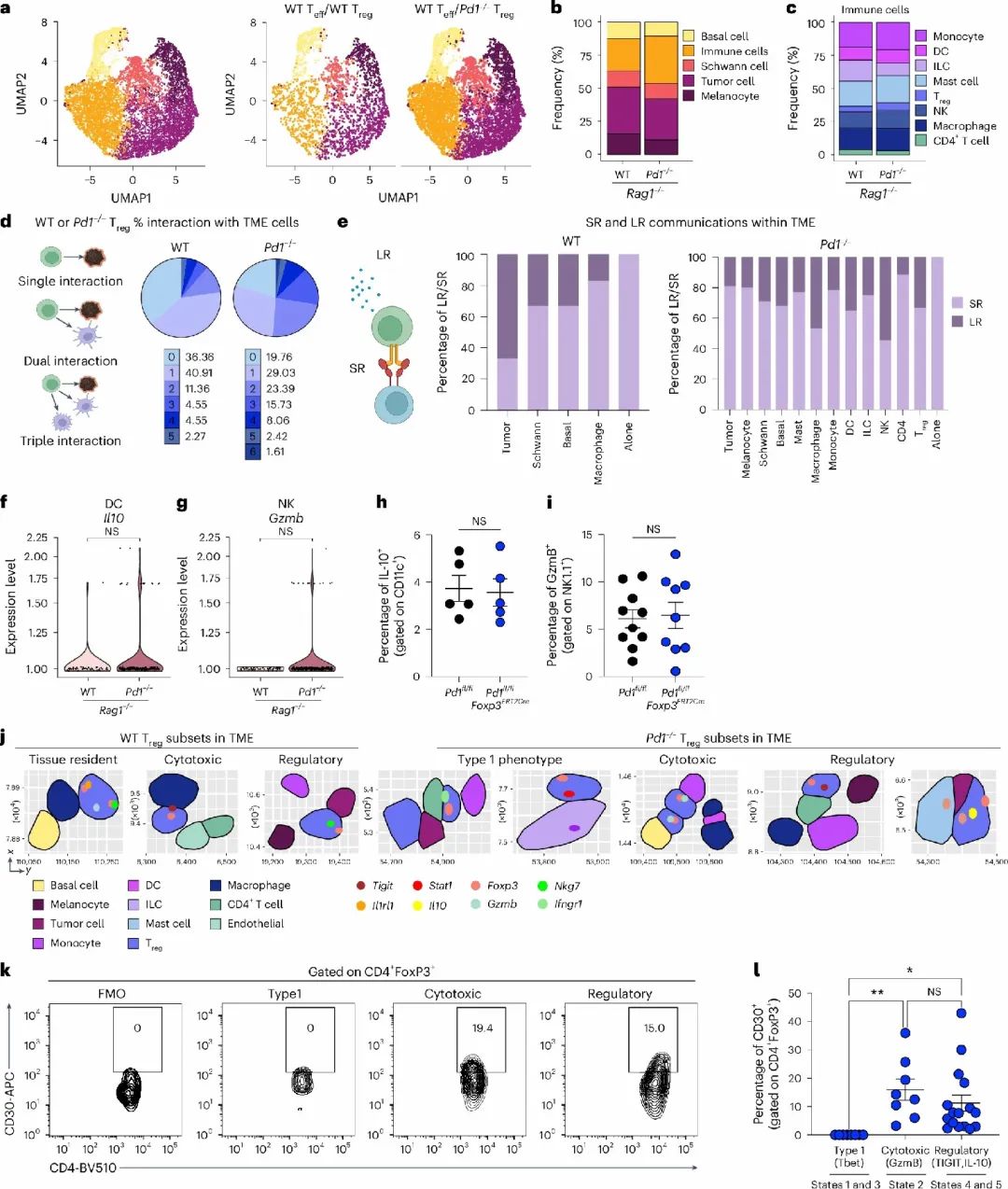 系中的共同定位和myCAF的标志性评分
系中的共同定位和myCAF的标志性评分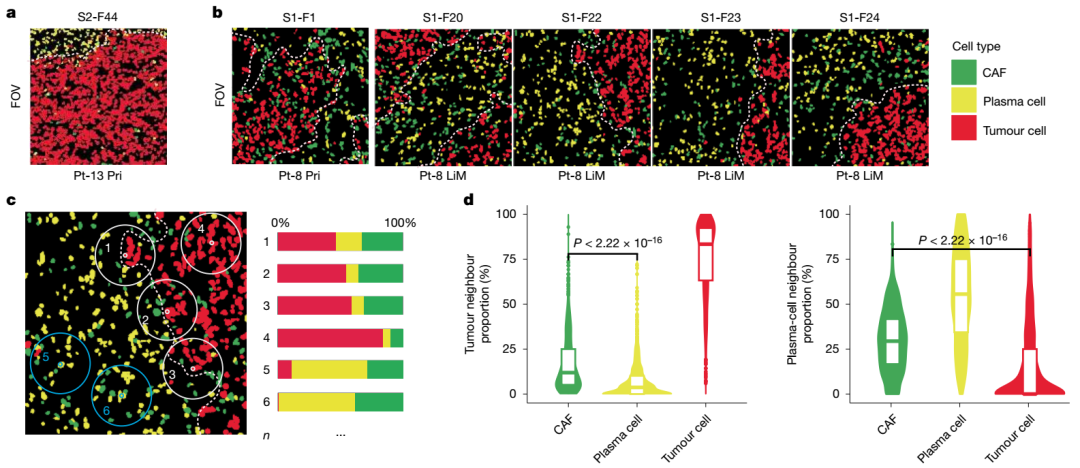 SMI揭示Treg在肿瘤中的空间定位与免疫互作网络
SMI揭示Treg在肿瘤中的空间定位与免疫互作网络文章总结
本研究通过多种小鼠模型的验证,结合单细胞和空间转录组技术,从功能、机制与空间分布等多个维度系统地解析了PD-1在Treg细胞中的调控作用。结果显示,PD-1缺失通过激活STAT5信号通路,促使CD30高表达,从而显著增强Treg细胞的免疫抑制功能。同时,空间组学分析显示,PD-1缺失Treg细胞在组织中位置发生变化,并与周围免疫细胞形成新的互作模式,共同塑造抑制性肿瘤微环境。研究提出,联合靶向PD-1与CD30可能有效克服肿瘤免疫治疗中的抵抗机制,为提升黑色素瘤免疫治疗效果提供了新的策略和潜在干预靶点。
相关文章
更多 >

