crRNA驱动级联反应实现ctDNA中PIK3CA H1047R突变的超灵敏检测
2025-10-15 来源:本站 点击次数:29循环肿瘤DNA(ctDNA)作为癌症早期诊断和动态监测的关键生物标志物,其超灵敏检测面临核心挑战。早期患者ctDNA突变等位基因频率(VAF)常低于0.1%,而传统组织活检因侵入性风险、肿瘤异质性及样本可及性限制难以满足实时监测需求。现有高灵敏度技术如液滴数字PCR(ddPCR)和二代测序(NGS)虽可检测低丰度突变,但前者依赖热循环仪与复杂设备,后者需繁琐的文库构建和生物信息学分析,且成本高昂,难以适配床旁检测场景。等温扩增技术虽规避了热循环限制,却易受非特异性扩增干扰,制约检测准确性。
CRISPR/Cas系统凭借高特异性靶向能力为分子诊断带来突破,其中Cas14a因其最小化结构、单链DNA特异性切割及无需PAM序列的特性,展现出优于Cas12a的识别稳定性。然而,CRISPR直接检测灵敏度通常仅达皮摩尔级,难以满足早期癌症ctDNA检测需求。研究通过创新性整合RPA扩增与CRISPR/Cas14a系统,利用二者最适温度匹配的特性,构建双重优化机制,RPA实现目标指数富集提升灵敏度,Cas14a特异性切割消除非特异背景信号,为超灵敏检测奠定基础。
乳腺癌全球年新发病例超230万,PIK3CA H1047R突变通过组成性激活PI3Kα通路驱动内分泌治疗耐药,其早期检测对改善预后至关重要。基于此,哈尔滨医科大学附属肿瘤医院乳腺外科庞达、张显玉团队在这项研究中,通过T7酶选择性消化RPA扩增产物反义链,实现无热循环的ssDNA转化;进一步采用工程化crRNA设计合成单核苷酸错配,将CRISPR/Cas14a单碱基分辨率应用于PIK3CA H1047R突变特异性识别,在32例临床样本中实现与ddPCR相当的100%敏感性与特异性,且检测限达0.01%。该系统结合数字微流控芯片,可在37℃下60分钟内完成检测,为精准肿瘤学提供可扩展的床旁诊断平台。研究成果发表于“Advanced science”期刊,题为“Engineered crRNA Drives RPA-T7-CRISPR/Cas14a Cascade for Ultrasensitive Detection of ctDNA PIK3CA H1047R”。

首先,为了满足ctDNA中SNP的超灵敏检测,研究人员开发了TIDE-Cas14a系统。从血浆提取的ctDNA直接加入包含RPA扩增试剂、T7外切酶、Cas14a蛋白及工程化crRNA的预混体系。先将RPA在37℃等温条件下对目标序列进行指数级扩增,生成双链DNA(dsDNA)产物;随后,T7外切酶特异性降解磷酸化修饰的反义链,保留PT修饰的正义链,完成无需热循环的ssDNA转化。关键在于crRNA的合成错配设计,通过在非种子区引入单核苷酸取代,显著增强Cas14a/crRNA-ssDNA复合物对靶标结合的特异性,即使野生型与突变序列同源性超99.9%,系统仍能精准识别PIK3CA H1047R等单碱基变异。靶标结合触发Cas14a的侧切活性,切割ssDNA荧光探针,释放可实时检测的荧光信号。进一步结合数字微流控芯片技术,将反应体系分割为10^5个纳米级液滴进行并行检测,通过荧光显微镜定量阳性信号比例,使灵敏度提升至attomolar级别,检测全程在60分钟内完成,且与ddPCR相比展现出100%的临床符合率。
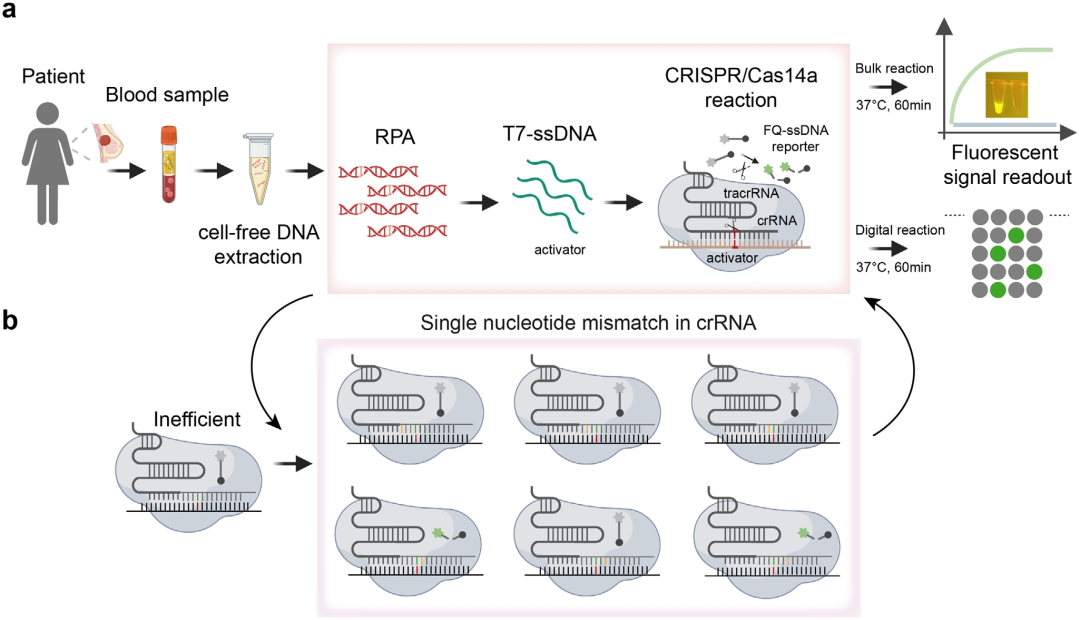
图1 TIDE-Cas14a系统的工作流程
然后,为提升PIK3CA H1047R突变检测特异性,研究人员将合成错配策略应用于Cas14a系统。基于Cas14a对种子区碱基高度敏感的特性,通过系统引入单核苷酸错配优化crRNA设计(图2B)。在SNP位点上下游7个位置构建六种crRNA变体,实验发现+1或+3位点引入错配可显著增强突变体/野生型区分能力(图2D-I)。其中+1位点错配crRNA使信噪比提升三倍,被选为PIK3CA检测最优方案。
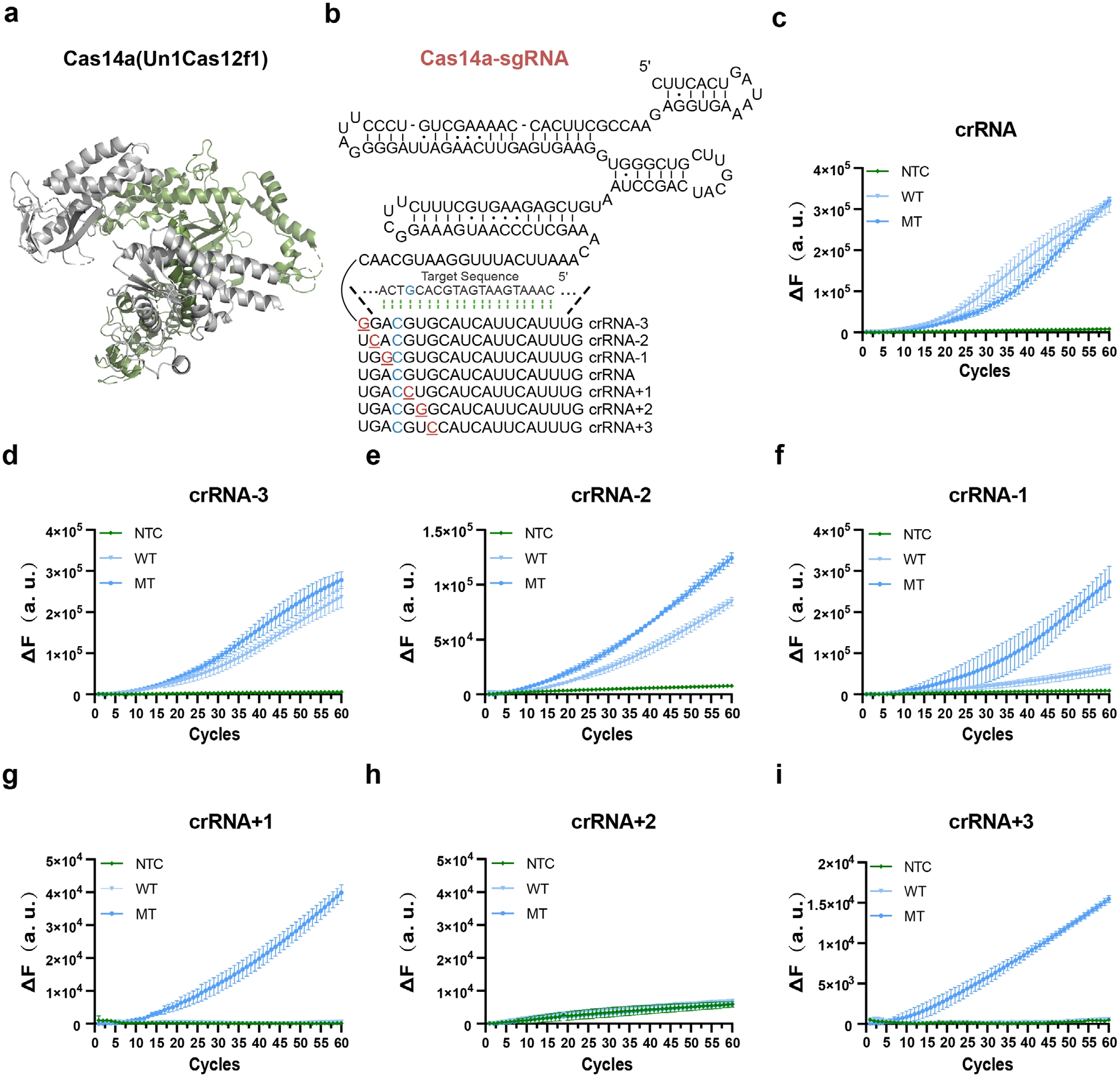
图2 通过对crRNA进行工程化改造以提高信噪比
为了验证该策略的实用型,进一步验证于肺癌和结直肠癌关键驱动突变。研究人员采用了相同的crRNA设计原理,在肺和结直肠癌中进行关键的致癌突变,包括EGFR T790M、EGFR L858R、BRAF V600E及KRAS G12V,均实现单碱基分辨(图3B/D/F/H)。分子对接模拟显示含错配crRNA的三元复合物结合野生型DNA时对接评分显著降低,表明其结合能下降。尤其对于EGFR L858R,原始crRNA与错配crRNA-2均能有效区分突变,与对接评分未显著变化的现象一致,证实错配设计通过破坏Cas14a与野生型序列的亲和力提升特异性。
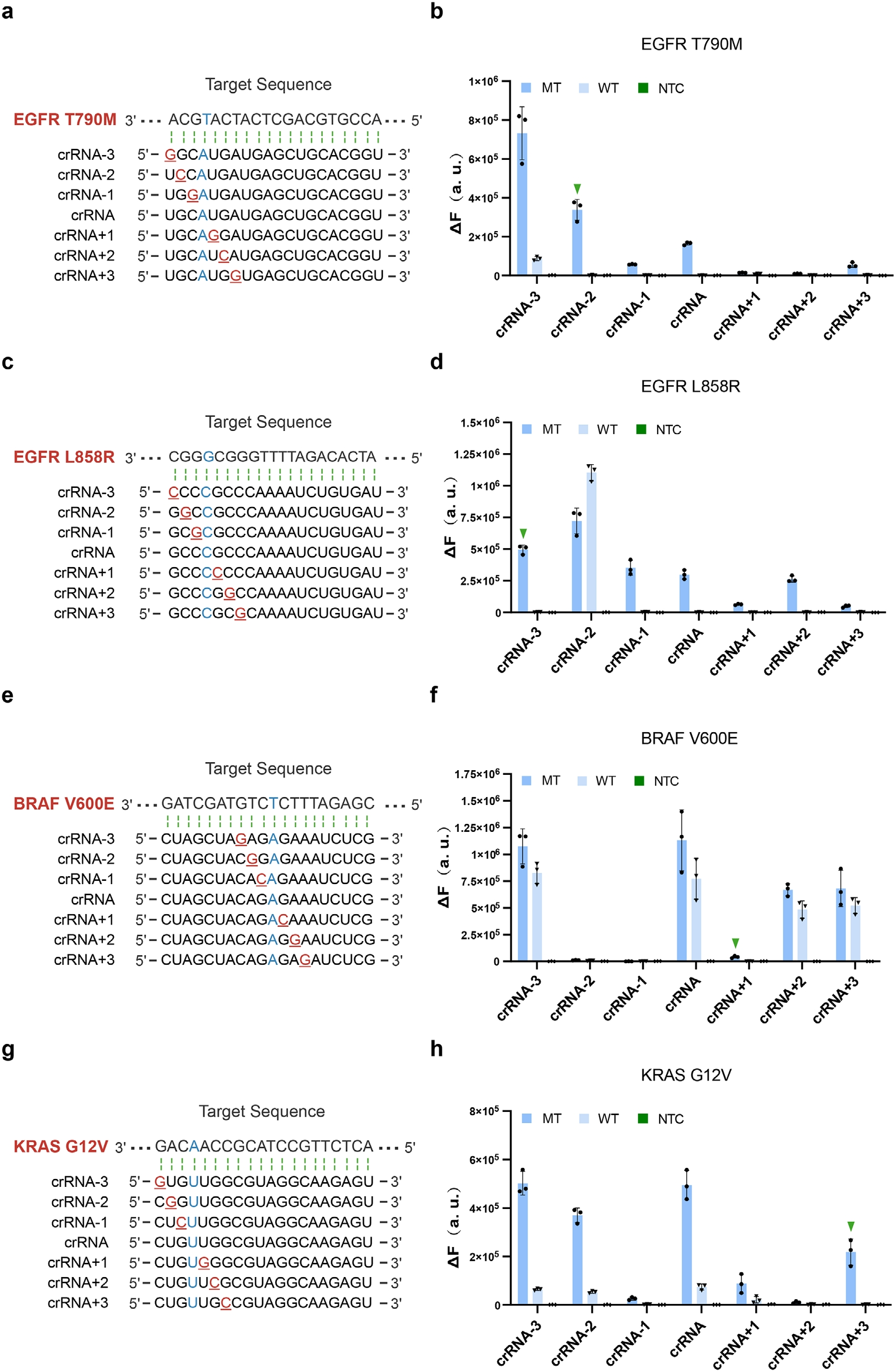
图3 工程化crRNA实现了对临床相关致癌突变的特异性检测
接着,研究人员通过系统筛选PIK3CA H1047R扩增引物,确定F1R1引物对在39℃/20分钟条件下可实现高效特异性扩增(图4C-E)。将RPA扩增与T7-CRISPR/Cas14a检测整合为单管反应体系,经两步法预验证可行性后,重点优化关键组分参数,Cas14a与sgRNA以1:1比例协同作用时荧光信号最强,同时探针浓度优化至625 nM以平衡信噪比(图4G-I);T7外切酶浓度≥2.5 U/μL即可完成链转换,且不产生背景噪声(图4J);37℃恒温反应60分钟实现检测全程闭环(图4K)。最终确立最优体系包含480 nM RPA引物、625 nM Cas14a/sgRNA复合物、625 nM ssDNA探针及2.5 U/μL T7酶。功能验证实验表明,仅当目标ctDNA(1 ng/μL)激活完整反应体系时,Cas14a的侧切活性可特异性切割FAM-BHQ1探针释放荧光,证实目标依赖的信号放大机制。该优化方案使检测限达0.01%,为后续临床验证奠定技术基础。
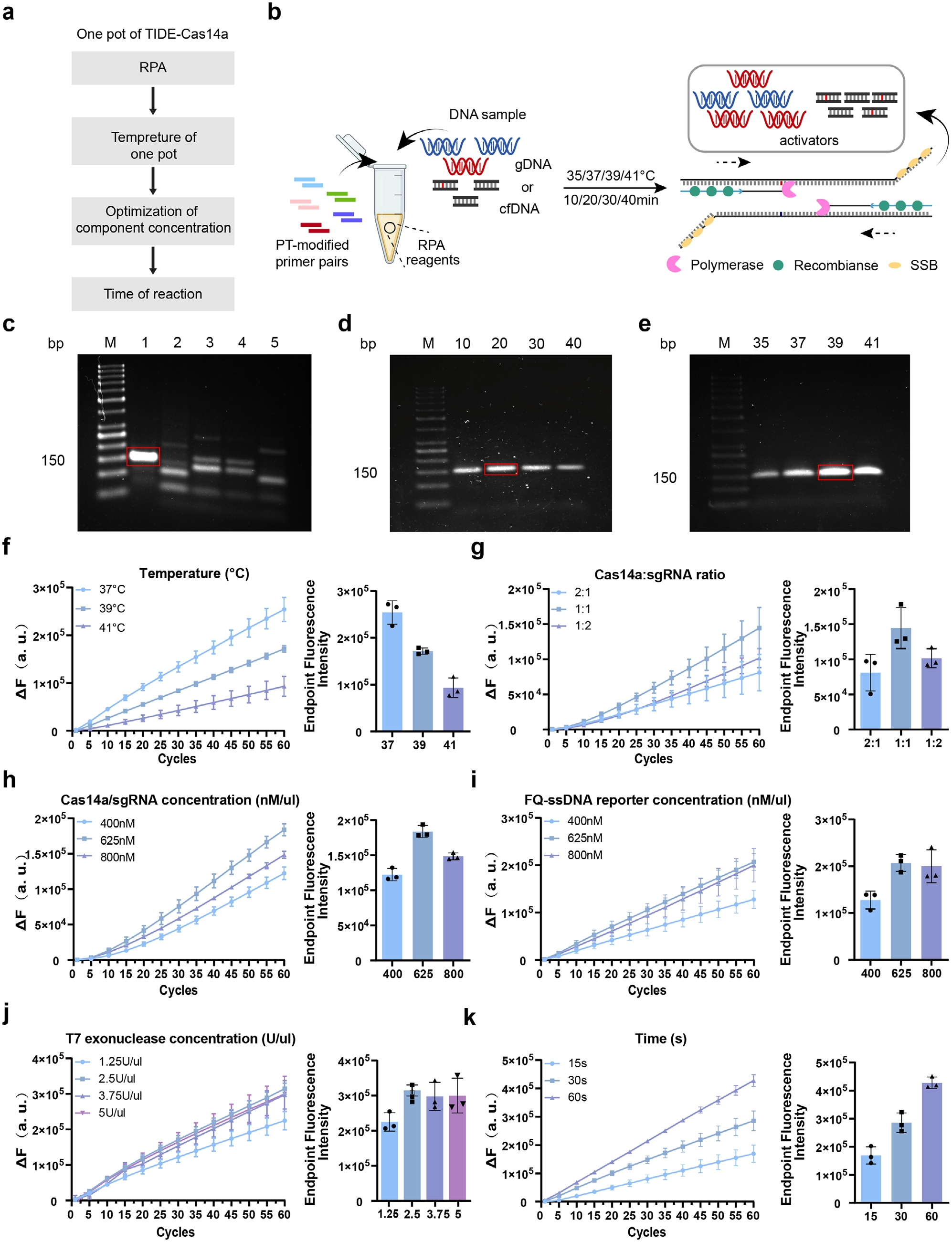
图4 TIDE-Cas14a系统的建立与优化
为了评估用于核酸分析TIDE-Cas14a系统的定量能力和适用性,研究人员通过细胞系gDNA梯度稀释实验证实其检测限(LOD)达0.01% VAF(图5C-E)。在模拟生理条件下,系统对PIK3CA H1047R突变表现出优异定量能力。ΔF与VAF对数值线性相关,且微流控芯片在0.001% VAF时仍可检测单分子信号(图5C)。特异性验证显示系统可精准区分突变亚型,无交叉反应(图5G),有效规避肿瘤异质性干扰。与金标准ddPCR的对比实验采用相同样本。ddPCR的检测阈值为0.1% VAF,而TIDE-Cas14a在0.01% VAF仍稳定检出,灵敏度提升10倍(图5I)。重复性验证涵盖不同操作者、试剂批次及实验日期,荧光信号变异系数<5%,证实系统具备临床诊断级稳定性。
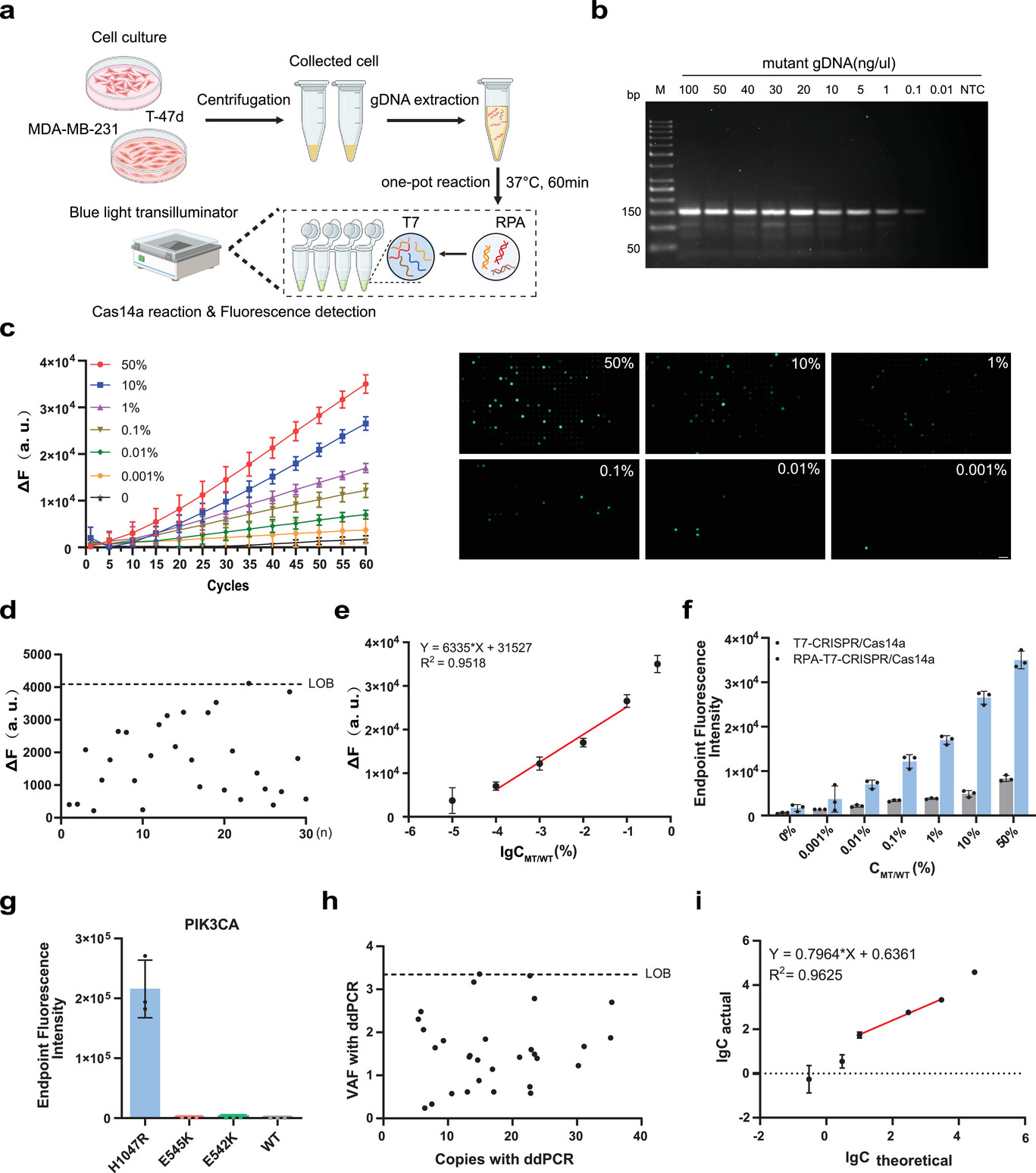
图5 TIDE-Cas14a系统在检测细胞系基因组DNA中PIK3CA H1047R突变的性能分析
接下来,为了评估TIDE-Cas14a系统在临床实践中的敏感特异性,研究人员收集了来自32例乳腺癌患者的组织与血浆样本,TIDE-Cas14a系统展现出zhuoyue性能,与组织ddPCR结果相比,检测敏感性与特异性均达100%(图6C);血浆ctDNA检测中,系统检出率显著优于ddPCR,成功捕获ddPCR漏诊的2例IA期患者的微弱突变信号(图6D-E);对低丰度ctDNA的检出能力,证实其在早期肿瘤及微小残留病灶监测中的潜力。

图6 使用TIDE-Cas14a系统和ddPCR在临床样本中检测PIK3CA H1047R突变
最后,研究人员将TIDE-Cas14a系统与自研数字微流体芯片整合,构建可定量检测血浆PIK3CA H1047R突变的微流控平台(图7A-C)。芯片采用三层结构设计,上下玻璃层与含10^5微腔阵列的PDMS芯片体,通过虹吸效应实现检测液快速填充,避免堵塞风险。微腔密度较传统数字PCR提升两个数量级,显著增强稀有突变信号捕获能力。临床验证中,芯片基于荧光强度半定量分级策略,在32例乳腺癌样本中与常规TIDE-Cas14a检测结果高度一致,精准识别5例阳性样本(图7C)。虽暂未实现绝对定量,但其在>95%野生型背景下的突变识别能力已有所突破。该系统通过微腔并行反应将灵敏度推升至单分子级,且芯片制造采用可规模化的PDMS复制成型工艺,成本较商用数字PCR降低80%。该技术为肿瘤突变筛查提供兼具超灵敏、低成本特性的床旁诊断新方案。
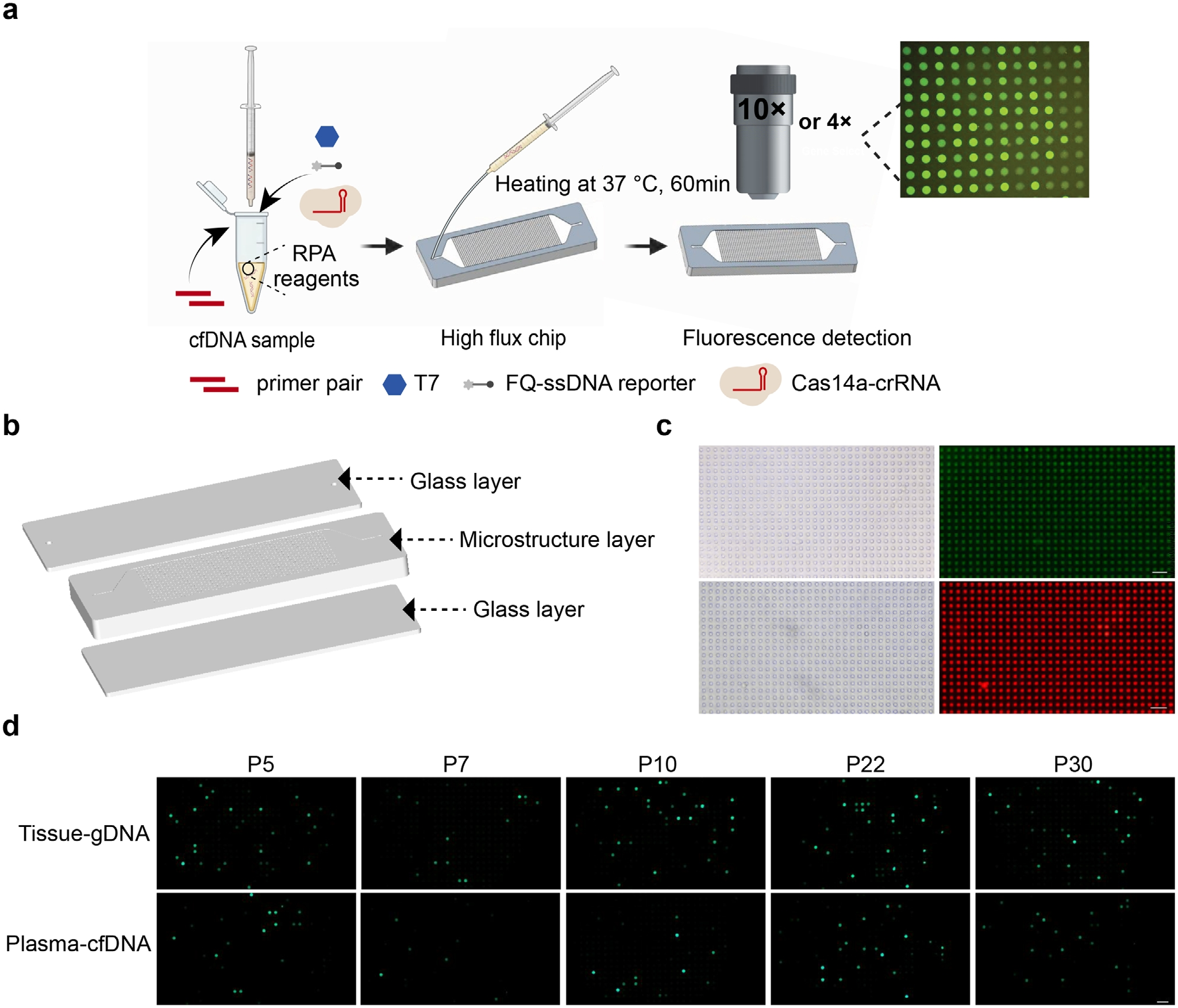
图7 TIDE-Cas14a系统与数字微流控芯片的联用
总之,研究开发的TIDE-Cas14a平台通过三重创新突破液体活检瓶颈,融合RPA等温扩增、T7外切酶链转换及CRISPR/Cas14a特异性切割,37℃恒温1小时内完成检测;在crRNA特定位置引入G/C碱基错配,实现单碱基分辨率,灵敏度较ddPCR提升10倍;集成10万微腔阵列,单分子检测能力达0.001% VAF,成本降低80%。临床验证显示,32例乳腺癌样本中与组织活检一致性达100%,并成功检出ddPCR遗漏的早期患者。该系统突破传统方法在低丰度突变检测中的局限,支持PIK3CA、EGFR等关键驱动基因分析,为早期癌症诊断、MRD监测提供床旁解决方案。
参考文献:Y. Yu, M. Jin, W. Yuan, et al. “ Engineered crRNA Drives RPA-T7-CRISPR/Cas14a Cascade for Ultrasensitive Detection of ctDNA PIK3CA H1047R.” Adv. Sci. (2025): e07126.
原文链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202507126
图片来源:所有图片均来源于参考文献
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!进入官网www.naturethink.com或关注“Naturethink”公众号,了解更多相关内容。
点击了解:仿生流体剪切应力系统

