2型糖尿病的发病机制、治疗策略和建模方法
2025-11-13 来源:本站 点击次数:85糖尿病,一种以持续性高血糖为特点的代谢性疾病,其中葡萄糖作为能量来源未被充分利用,且由于糖异生和糖原分解不正常而产生过量,导致高血糖[1]。
传统上,糖尿病通常分为 4 种临床类型:

本文旨在全面剖析 2 型糖尿病的机制,当前的建模方法,并介绍多种治疗策略。
Section.01
2 型糖尿病
2 型糖尿病占所有糖尿病患者的 90%-95%。这类患者通常存在相对 (而非绝对) 的胰岛素缺乏和胰岛素抵抗 (Insulin resistance,即对胰岛素的生物反应降低) 。
胰岛素抵抗
一个具有正常代谢的人,胰岛素是在进食后由胰腺内的胰岛 β- 细胞分泌的,它传递信号给体内的胰岛素感应组织 (例如肌肉与脂肪),使细胞膜表面产生葡萄糖运体 4 型 (GLUT4) 吸收葡萄糖来降低血糖含量到一个正常值。
在一个胰岛素抗性的人体内,正常水平的胰岛素无法激发诱导肌肉和脂肪细胞吸收葡萄糖的信号。为了对此进行补偿,胰岛素抗性个体的胰腺释放大量的胰岛素,以使足够的细胞被激发来吸收葡萄糖。
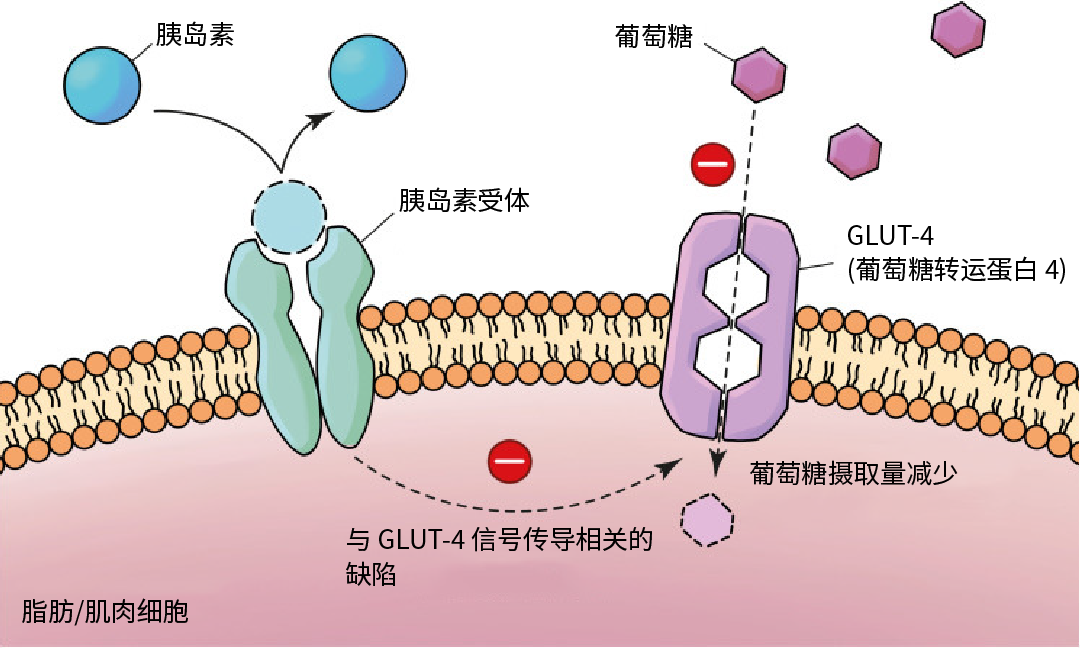
图 1. 2 型糖尿病的病理生理学[2]。
而在二型糖尿病情况下,胰腺 β- 细胞无法产生足够的胰岛素来保持正常血糖水平。GLUT4 信号传导机制缺陷会导致肌肉和脂肪细胞的葡萄糖摄入量减少 (图 1),从而进一步增加 β 细胞产生更多胰岛素的负担。β- 细胞在高血糖的情况下无力分泌更多的胰岛素是从胰岛素抗性向二型糖尿病转变的特征。
发病机制简述
2 型糖尿病的病因多种多样,具体病因尚不清楚。但胰岛素抵抗 (IR) 和继发性β细胞功能障碍导致血糖升高占大多数。如前所述,血糖升高会引发高糖毒性,导致胰岛素抵抗加重和 β 细胞功能受损,形成恶性循环,导致血糖进一步升高至糖尿病水平,甚至引发高血糖危象。
长期暴露于过度营养相关的代谢产物 (如升高的葡萄糖、非酯化脂肪酸) 会破坏胰岛素受体激活及 IRS-1/PI3K/Akt2 信号通路,进而引发慢性脂肪组织炎症、异位脂质沉积 (肝脏/肌肉)、内质网应激 (ERS)、氧化应激等一系列病理过程。这些病理改变共同促进 2 型糖尿病 (T2D) 的发生、发展及靶器官损伤 (TOD)。
此外,高血糖症和其他代谢紊乱,例如血脂异常、炎症因子、IAPP 过量和肠道菌群改变,共同通过炎症、内质网应激和氧化应激等途径,导致胰岛素抵抗和/或 β 细胞功能障碍 (图 2)。
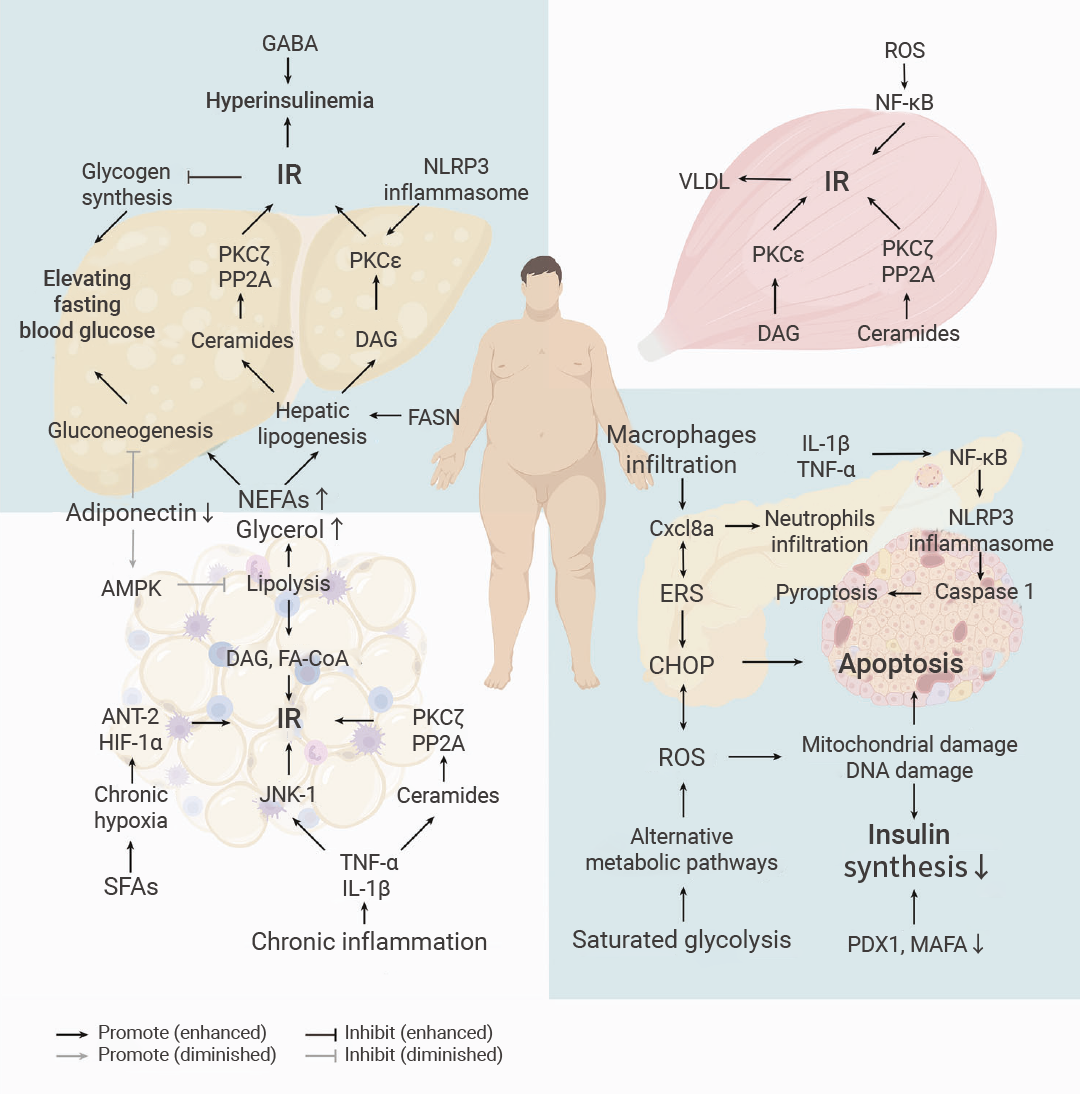
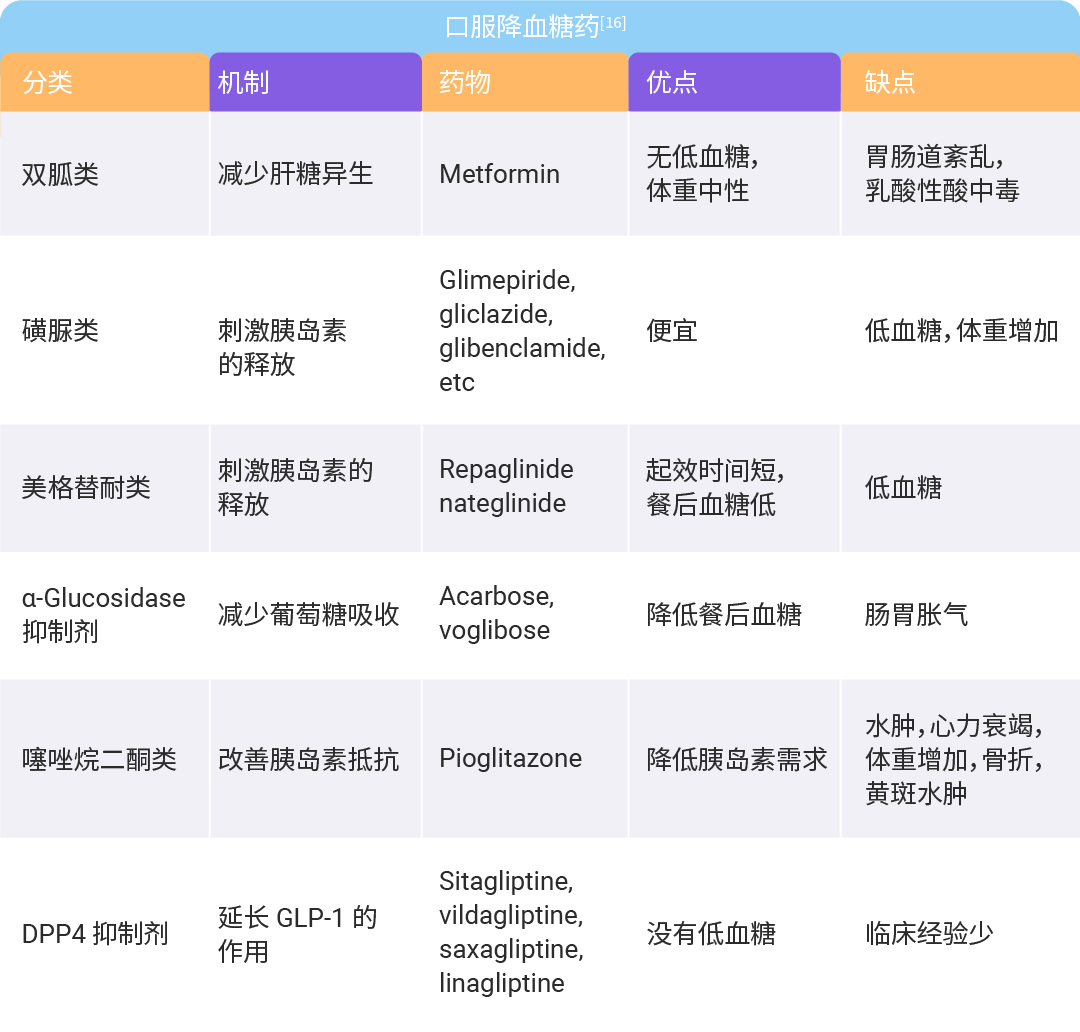
图 2. 2 型糖尿病的发病机制[3]。
简而言之,在饱和脂肪酸 (SFAs) 的刺激下,SFAs 代谢增强导致脂肪细胞缺氧,巨噬细胞浸润释放炎症因子,导致脂肪组织发生慢性炎症,从而导致脂肪细胞胰岛素抵抗 (IR) 和脂肪分解增加。脂肪分解产生的非甾体脂肪酸 (NEFAs) 和甘油导致肝脏脂质合成增加、糖异生和异位脂肪沉积,一方面影响 IRS-1/PI3K/Akt2 的磷酸化,另一方面增加肝脏葡萄糖释放。同时,肌肉中也发生异位脂肪沉积,导致循环中极低密度脂蛋白 (VLDL) 升高,进一步加剧肝脏脂质代谢紊乱和 IR。营养过剩和 IR 导致持续的高血糖和循环中过量的脂肪酸,通过一些共同的途径,包括炎症、内质网应激 (ERS) 和氧化应激,进一步损害 β 细胞功能和质量。
了解了 2 型糖尿病复杂的发病机制,那么,在实验室中,研究人员如何模拟这一过程,以筛选有效的药物并深入探究其治疗靶点呢?这就离不开至关重要的动物模型!通过构建能模拟人类疾病特征的动物模型,才能将基础理论与药物研发连接起来。
Section.02
2 型糖尿病的实验建模方法
糖尿病模型可分为自发型模型、诱导型 (化学诱导、手术诱导等) 模型和基因工程模型等。
目前,在糖尿病模型中,诱导模型因其方法完善、易于实现而被广泛应用。在动物模型中,物理干预 (如胰腺切除术)、饮食改变 (如高糖和高脂肪饮食) 和化学制剂都可以有效诱导糖尿病。饮食+化学诱导模型常被选作评估抗糖尿病药物的首选方案,45% 和 60% 脂肪供能饮食与 STZ 或 ALX 注射联用一般被广泛用于大小鼠 2 型糖尿病造模[4]。
表 2. 诱导大小鼠 2 型糖尿病的不同方法[5][6][7][8][9]。






关于 MCE
MCE 可提供糖尿病造模的纯化型饲料、化学诱导剂。化学小分子参考药典标准或市场领先标准,严格监控单杂、重金属、内毒素等影响因素。纯化型饲料配方比例公开,对标国际饲料效果,高脂 60(HY-AF0005) 饲料可提供权威第三方关于重金属、微生物等项目检测报告。

模型评价指标
目前,动物模型糖尿病诊断尚无标准化共识。
(1) 通常采用随机血糖水平作为动物模型糖尿病诊断的主要标准。血糖水平超过 300 mg/dL (16.7 mmol/L) 的动物被视为糖尿病患者。若采用空腹血糖检测,可根据研究目的将 150 mg/dL (8.3 mmol/L) 或 200 mg/dL (11 mmol/L) 以上数值作为高血糖指标。当无法进行多次采血时,NOD 小鼠出现糖尿现象可视为糖尿病征兆[10]。
(2) 附加指标:糖尿病动物模型中常见饮水量增加、尿量增多及体重下降现象。随着糖尿病发展,血清生化指标 (包括总胆固醇、天冬氨酸氨基转移酶、甘油三酯及低密度脂蛋白 (LDL)) 亦呈现显著升高[11][12]。
通过上述多种建模方法,我们得以在实验室中“复刻”2 型糖尿病的病理进程,这为下一步——筛选和验证各种治疗策略,提供了不可或缺的研究平台。那么,针对 2 型糖尿病复杂的发病机制,目前有哪些主流的治疗策略呢?
Section.03
2 型糖尿病的治疗策略
日常干预
生活方式干预已被证明在预防糖尿病方面非常有效。在无药物干预的情况下,体育锻炼、代谢营养治疗及体重管理等可使糖化血红蛋白水平降低 0.3% 至 2%,某些情况下甚至能实现糖尿病缓解[3]。
经典靶点
2 型糖尿病的经典治疗靶点包括 GLP-1、DPP-4 和 SGLT2,这些靶点在调节葡萄糖稳态和增强胰岛素敏感性方面发挥着关键作用。
GLP-1 最显著的生理效应在于其促胰岛素分泌活性:该物质仅在高血糖状态下增强胰岛素分泌,从而最大限度降低低血糖风险。此外,它还能抑制 α 细胞分泌胰高血糖素——这一过程可能受局部 δ 细胞来源的生长抑素调控。 大量研究已利用 GLP-1 的降糖效应治疗 2 型糖尿病。然而,天然 GLP-1 的治疗潜力受限于其半衰期短且需通过非口服途径给药[13]。
为突破这些限制,已开发出两种药理学策略:二肽基肽酶 -4 (DPP-4) 抑制剂 (通过抑制蛋白水解降解来提高内源性 GLP-1 水平) 和 GLP-1 受体激动剂(结构类似肽类,可激活 GLP-1 受体,皮下注射后在体内具有持久活性)[13]。
相较之下,钠-葡萄糖共转运蛋白 2 (SGLT2) 抑制剂是通过肾脏机制发挥作用,阻断肾近曲小管的葡萄糖重吸收,从而增加糖尿并降低血糖浓度[14]。近期心血管结局研究证实,特定钠-葡萄糖共转运蛋白 2 抑制剂与 GLP-1 受体激动剂可显著降低心肾事件风险。
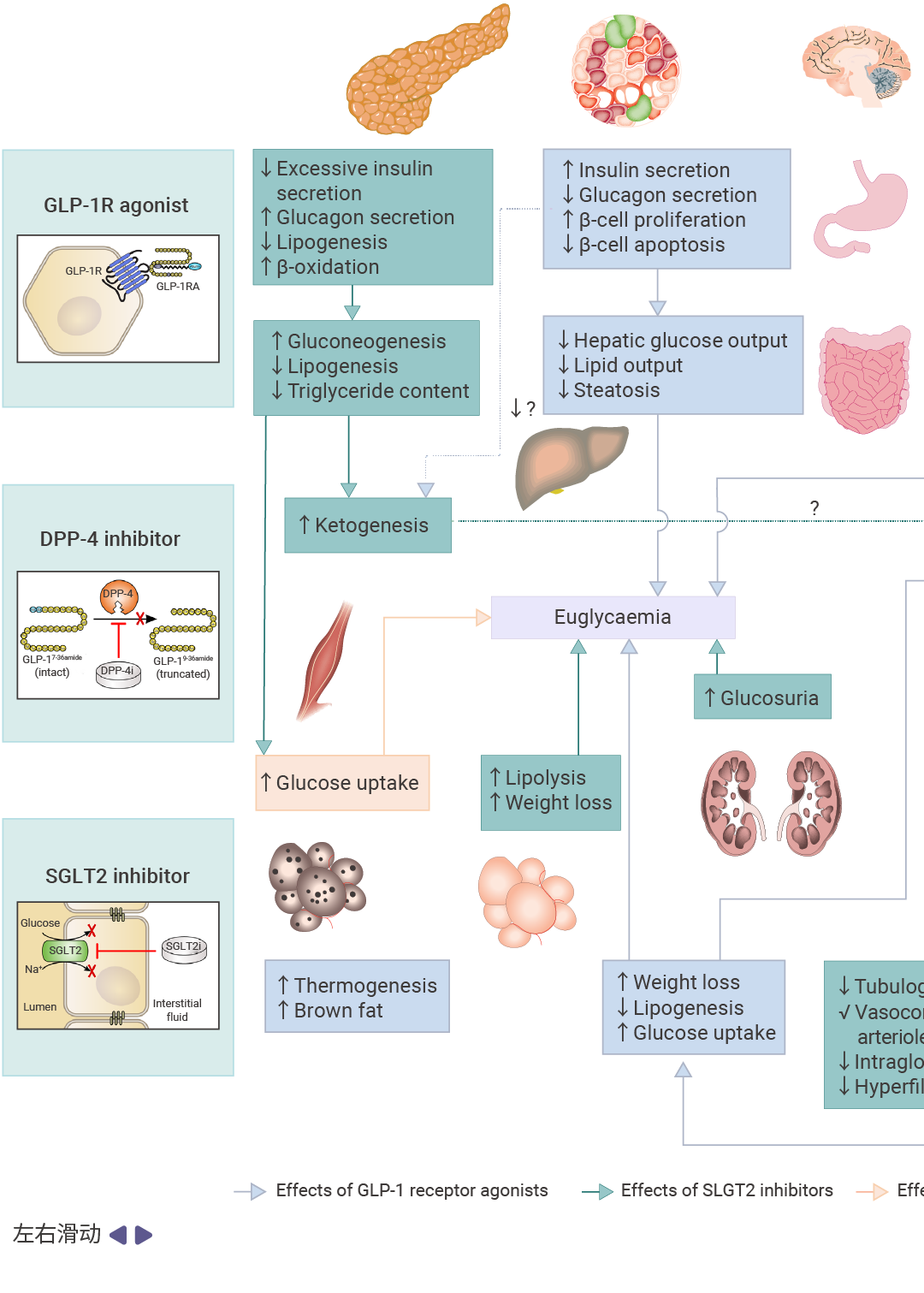
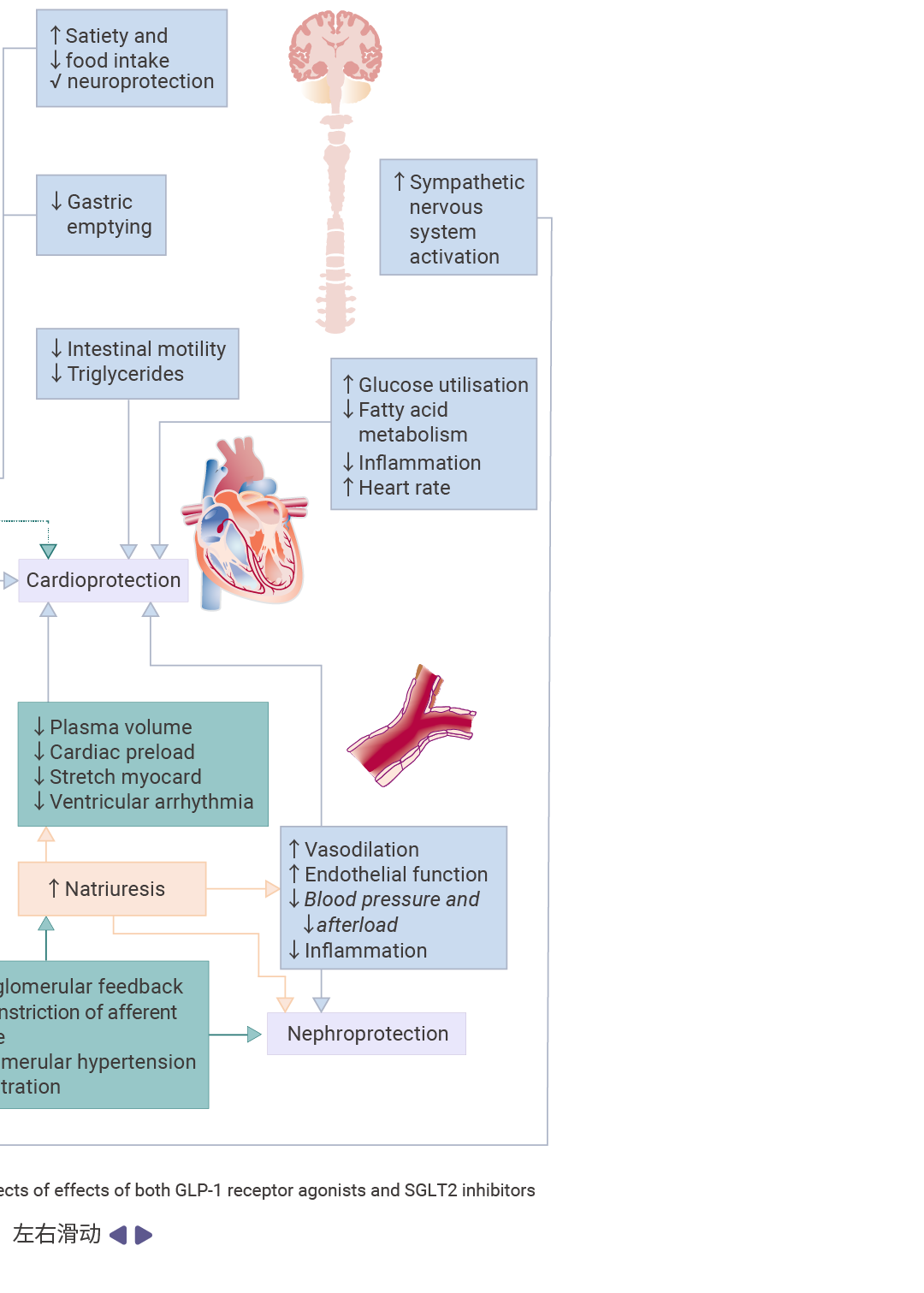
图 3. GLP-1 受体激动剂、DPP-4 抑制剂和 SGLT2 抑制剂的作用机制[15]。
药物治疗
目前尚无任何药物被 FDA 证实可用于预防 2 型糖尿病的特定适应症。不过,一些降血糖药二甲双胍 (Metformin)、α- 葡萄糖苷酶抑制剂 (AGIs)、噻唑烷二酮类药物 (TZDs)、钠-葡萄糖协同转运蛋白抑制剂 (SGLT-is, 分为两类:SGLT-2i 和 SGLT-1 与 SGLT-2 双重抑制剂,SGLT-1/2i) 和胰高血糖素样肽 -1 (GLP-1) (活性成分是GLP-1) 已被研究证明可以预防 2 型糖尿病[3]。

二甲双胍是第一个研究其降低 2 型糖尿病风险的降糖药,在 DPP 和 IDPP 试验中,二甲双胍分别使 2 型糖尿病风险降低 31% 和 26.5%。二甲双胍在预防糖尿病方面得到了充分的研究,并被美国糖尿病协会推荐用于T2D高风险患者[3]。然而,就降低糖尿病风险而言,它可能不如利拉鲁肽、索马鲁肽或 TZDs 有效 (无直接的对比研究)。
MCE 明星产品
注意:MCE 的所有产品仅用作科学研究或药证申报,我们不为任何个人用途提供产品和服务。


















Section.04
小结
2 型糖尿病的患病率显著上升,有效管理需要个性化策略,将生活方式干预 (如体育锻炼和代谢营养治疗) 与药物治疗相结合。动物模型的建立可以成为阐明疾病病理生理机制和推动药物研发的关键途径。MCE 可提供高质量的诱导糖尿病模型的造模产品以及助力糖尿病治疗的活性小分子、蛋白大分子。助力糖尿病研究,我们在行动!

[2] Chellappan DK, et al. Hypoglycaemic Molecules for the Management of Diabetes Mellitus from Marine Sources. Diabetes Metab Syndr Obes. 2023 Jul 25;16:2187-2223.
[3] Lu X, et al. Type 2 diabetes mellitus in adults: pathogenesis, prevention and therapy. Signal Transduct Target Ther. 2024 Oct 2;9(1):262.
[4] Martín-Carro B, et al. Experimental Models to Study Diabetes Mellitus and Its Complications: Limitations and New Opportunities. Int J Mol Sci. 2023 Jun 18;24(12):10309.
[5] Zhang D, et al. Hesperetin-Enhanced Metformin to Alleviate Cognitive Impairment via Gut-Brain Axis in Type 2 Diabetes Rats. Int J Mol Sci. 2025 Feb 23;26(5):1923.
[6] Liu X, et al. Discovery and identification of semaphorin 4D as a bioindicator of high fracture incidence in type 2 diabetic mice with glucose control. J Adv Res. 2025 Mar 10:S2090-1232(25)00174-2.
[7] Akhtar MF, et al. Ameliorating Effect of Malva neglecta Wallr on Obesity and Diabetes in Wistar Rats: A Mechanistic Study. Biomed Res Int. 2022 May 28;2022:2614599.
[8] Udumula, M.P., et al. High fructose and streptozotocin induced diabetic impairments are mitigated by Indirubin-3-hydrazone via downregulation of PKR pathway in Wistar rats. Sci Rep 11, 12924 (2021).
[9] Awai M, et al. Induction of diabetes in animals by parenteral administration of ferric nitrilotriacetate. A model of experimental hemochromatosis. Am J Pathol. 1979 Jun;95(3):663-73.
[10] Yagihashi S. Contribution of animal models to diabetes research: Its history, significance, and translation to humans. J Diabetes Investig. 2023 Sep;14(9):1015-1037.
[11] Zhang XT, et al. Baicalin reversal of DNA hypermethylation-associated Klotho suppression ameliorates renal injury in type 1 diabetic mouse model. Cell Cycle. 2020 Dec;19(23):3329-3347.
[12] Udumula MP, et al. High fructose and streptozotocin induced diabetic impairments are mitigated by Indirubin-3-hydrazone via downregulation of PKR pathway in Wistar rats. Sci Rep. 2021 Jun 21;11(1):12924.
[13] Meier JJ. GLP-1 receptor agonists for individualized treatment of type 2 diabetes mellitus. Nat Rev Endocrinol. 2012 Dec;8(12):728-42.
[14] Hattersley AT, et al. Type 2 Diabetes, SGLT2 Inhibitors, and Glucose Secretion. N Engl J Med. 2015 Sep 3;373(10):974-6.
[15] De Block C. SGLT2 inhibitors and GLP-1 receptor agonists: a sound combination. Lancet Diabetes Endocrinol. 2018 May;6(5):349-352.
[16] Kang H. Current therapeutic agents and anesthetic considerations for diabetes mellitus. Korean J Anesthesiol. 2012 Sep;63(3):195-202.



