Portal环状RNA递送技术无需基因组整合即可实现5天以上持久表达
2025-12-10 来源:本站 点击次数:455
在细胞治疗与基因功能研究中,研究人员常面临两难选择:mRNA表达快速但转瞬即逝,病毒载体虽能持久表达却存在基因组整合带来的安全风险。
如今,Portal公司带来了第三种选择——多重环状RNA递送技术,真正实现“鱼与熊掌兼得”:既能获得持久、高效的蛋白表达,又无需持久性改变细胞基因组。
谁将是Portal技术的受益者?
细胞治疗团队:如果您正在寻找持久性基因修饰(如病毒转导)的替代方案,以开发更安全的下一代细胞疗法。
研发与工艺开发人员:如果您需要在原代细胞中长时间过表达目标基因,用于功能研究或工艺优化,同时希望跳过繁琐、耗时的稳转细胞系构建过程。
四大核心优势
表达持久稳定:mRNA的半衰期很短,蛋白表达通常仅维持1–2天。而Portal递送的环状RNA凭借其独特的共价闭合环状结构,能够抵抗核酸外切酶的降解,在细胞内稳定表达超过5天,为长期功能研究提供保障。
无基因组整合风险:环状RNA在细胞质内独立翻译,不进入细胞核,不会整合至宿主基因组。在获得持久生物学效应的同时,避免了因基因插入突变引发的潜在安全风险。
无需碱基修饰:与传统mRNA不同,通过Portal机械穿孔技术递送的环状RNA,无需进行碱基修饰(如假尿嘧啶) 即可实现高效、稳定的蛋白表达,不仅简化生产工艺,也进一步降低了成本。
灵活的多重共递送:Portal专利的机械穿孔技术可轻松将多种环状RNA分子(如治疗性CAR基因与增强因子)按特定比例共同导入同一细胞,实现协同增效的“多重工程化”,为复杂细胞疗法设计开辟新路径。
数据印证实力:环状RNA在表达与功能上均表现卓越
验证一:环状RNA在免疫细胞中表达持久性显著优于mRNA
为评估环状RNA与mRNA的表达稳定性,本研究在体外培养的PBMC及纯化T细胞中,分别转染编码GFP报告基因的环状RNA与线性mRNA。mRNA组在转染后48小时内表达水平急剧下降,而环状RNA组在相同时间内维持稳定表达,直至第5天仍检测到显著荧光信号(图1)。
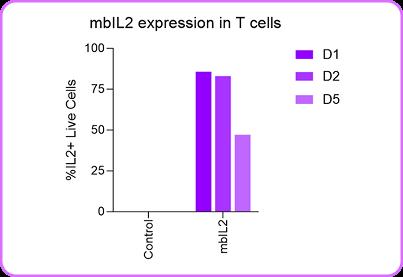
进一步采用突变型IL-2环状RNA增强T细胞功能,证实环状RNA可支持mbIL-2的持续分泌(图2),并显著提升CAR-T细胞对CD19阳性靶细胞杀伤活性(图3),其效应强度与表达持续时间呈正相关。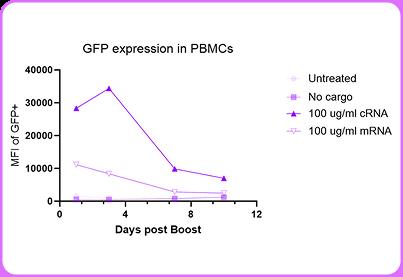 图1. 与mRNA相比,环状RNA在人类原代PBMC中的表达强度更高,且能持续长达10天之久。
图1. 与mRNA相比,环状RNA在人类原代PBMC中的表达强度更高,且能持续长达10天之久。
验证二:多重工程化实现协同高效杀伤
在更复杂的工程化T细胞中,我们构建了共表达CD19嵌合抗原受体与双功能增强因子(mbIL-2/IL-12)的环状RNA递送系统。通过优化共递送方式,当CD19 CAR与mbIL-12环状RNA同时转导时,实现了CAR与细胞因子的高效协同表达(图3)。
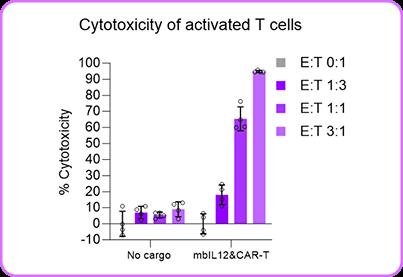
功能验证显示,经该联合增强方式处理的T细胞在效靶比3:1条件下,对CD19阳性肿瘤细胞杀伤效率显著提升,细胞毒性检测显示杀伤率超过90%(图4),较单一CAR表达组表现出统计学差异(p<0.01)。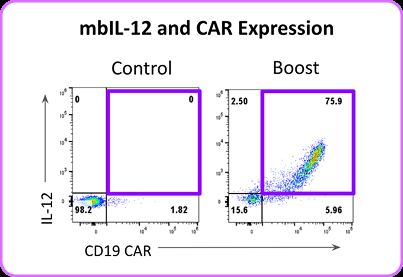 图3. 在T细胞导入(boost)48小时后,通过流式细胞术检测CD19 CAR与mblL-12的表达情况。
图3. 在T细胞导入(boost)48小时后,通过流式细胞术检测CD19 CAR与mblL-12的表达情况。
核心技术支撑:高效低损伤的机械挤压穿孔技术
本研究所采用的递送技术核心在于专利的机械挤压递送系统(Portal技术)。与电穿孔技术通过高压电场诱导细胞膜不可控破裂不同,Portal技术基于可控的物理力学机制,在细胞膜上瞬时形成直径约50-200 nm的纳米级孔道,实现环状RNA等大分子物质(分子量>100 kDa)的高效胞内递送。该过程具备以下技术优势:
细胞相容性:机械挤压作用力可精确控制,显著降低细胞膜损伤(细胞存活率>95%),避免电穿孔导致的细胞应激反应等。
递送效率:通过优化挤压参数(压力梯度、作用时间等),可使环状RNA在T细胞中的转染效率达85%以上,较传统电穿孔提升2-3倍。
功能保持:经Portal技术处理细胞保持完整细胞周期分布,为后续功能验证提供可靠细胞模型。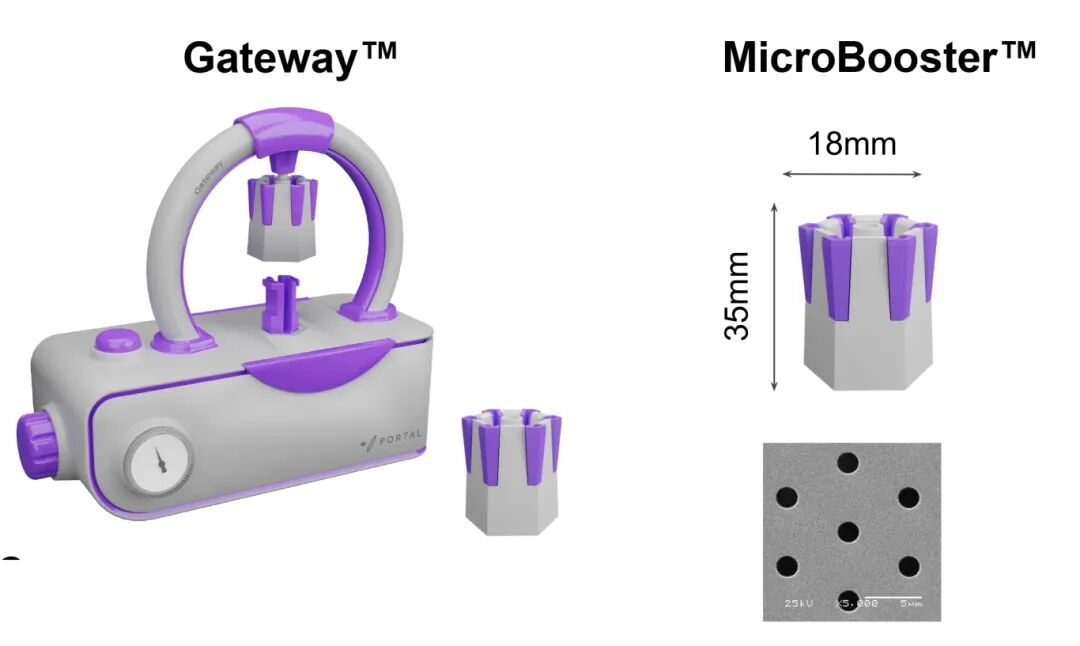

未来展望
Portal环状RNA递送平台为解决细胞治疗与基础研究中“表达时长”与“安全性”之间的矛盾,提供了一个强大而灵活的工具。无论是开发更安全的现货型细胞疗法,还是开展复杂的基因功能筛选,这项技术都将助力您加速创新。
立即联系我们,了解如何将Portal环状RNA递送技术应用于您的研究项目!
如今,Portal公司带来了第三种选择——多重环状RNA递送技术,真正实现“鱼与熊掌兼得”:既能获得持久、高效的蛋白表达,又无需持久性改变细胞基因组。
谁将是Portal技术的受益者?
细胞治疗团队:如果您正在寻找持久性基因修饰(如病毒转导)的替代方案,以开发更安全的下一代细胞疗法。
研发与工艺开发人员:如果您需要在原代细胞中长时间过表达目标基因,用于功能研究或工艺优化,同时希望跳过繁琐、耗时的稳转细胞系构建过程。
四大核心优势
表达持久稳定:mRNA的半衰期很短,蛋白表达通常仅维持1–2天。而Portal递送的环状RNA凭借其独特的共价闭合环状结构,能够抵抗核酸外切酶的降解,在细胞内稳定表达超过5天,为长期功能研究提供保障。
无基因组整合风险:环状RNA在细胞质内独立翻译,不进入细胞核,不会整合至宿主基因组。在获得持久生物学效应的同时,避免了因基因插入突变引发的潜在安全风险。
无需碱基修饰:与传统mRNA不同,通过Portal机械穿孔技术递送的环状RNA,无需进行碱基修饰(如假尿嘧啶) 即可实现高效、稳定的蛋白表达,不仅简化生产工艺,也进一步降低了成本。
灵活的多重共递送:Portal专利的机械穿孔技术可轻松将多种环状RNA分子(如治疗性CAR基因与增强因子)按特定比例共同导入同一细胞,实现协同增效的“多重工程化”,为复杂细胞疗法设计开辟新路径。
数据印证实力:环状RNA在表达与功能上均表现卓越
验证一:环状RNA在免疫细胞中表达持久性显著优于mRNA
为评估环状RNA与mRNA的表达稳定性,本研究在体外培养的PBMC及纯化T细胞中,分别转染编码GFP报告基因的环状RNA与线性mRNA。mRNA组在转染后48小时内表达水平急剧下降,而环状RNA组在相同时间内维持稳定表达,直至第5天仍检测到显著荧光信号(图1)。
进一步采用突变型IL-2环状RNA增强T细胞功能,证实环状RNA可支持mbIL-2的持续分泌(图2),并显著提升CAR-T细胞对CD19阳性靶细胞杀伤活性(图3),其效应强度与表达持续时间呈正相关。


图2. mblL2环状RNA在T细胞中的表达可持续5天以上。
验证二:多重工程化实现协同高效杀伤
在更复杂的工程化T细胞中,我们构建了共表达CD19嵌合抗原受体与双功能增强因子(mbIL-2/IL-12)的环状RNA递送系统。通过优化共递送方式,当CD19 CAR与mbIL-12环状RNA同时转导时,实现了CAR与细胞因子的高效协同表达(图3)。
功能验证显示,经该联合增强方式处理的T细胞在效靶比3:1条件下,对CD19阳性肿瘤细胞杀伤效率显著提升,细胞毒性检测显示杀伤率超过90%(图4),较单一CAR表达组表现出统计学差异(p<0.01)。


图4. 经mblL-12与CD19 CAR环状RNA共增强的T细胞,
其双重表达呈现高度相关性,并展现出相应的协同杀伤效力。
其双重表达呈现高度相关性,并展现出相应的协同杀伤效力。
核心技术支撑:高效低损伤的机械挤压穿孔技术
本研究所采用的递送技术核心在于专利的机械挤压递送系统(Portal技术)。与电穿孔技术通过高压电场诱导细胞膜不可控破裂不同,Portal技术基于可控的物理力学机制,在细胞膜上瞬时形成直径约50-200 nm的纳米级孔道,实现环状RNA等大分子物质(分子量>100 kDa)的高效胞内递送。该过程具备以下技术优势:
细胞相容性:机械挤压作用力可精确控制,显著降低细胞膜损伤(细胞存活率>95%),避免电穿孔导致的细胞应激反应等。
递送效率:通过优化挤压参数(压力梯度、作用时间等),可使环状RNA在T细胞中的转染效率达85%以上,较传统电穿孔提升2-3倍。
功能保持:经Portal技术处理细胞保持完整细胞周期分布,为后续功能验证提供可靠细胞模型。


图5. Portal机械挤压穿孔技术工作原理
未来展望
Portal环状RNA递送平台为解决细胞治疗与基础研究中“表达时长”与“安全性”之间的矛盾,提供了一个强大而灵活的工具。无论是开发更安全的现货型细胞疗法,还是开展复杂的基因功能筛选,这项技术都将助力您加速创新。
立即联系我们,了解如何将Portal环状RNA递送技术应用于您的研究项目!
相关文章
更多 >

