抗体偶联药物(ADC)Antibody从靶点发现到抗体工程化的全流程深度解析
2026-02-09 来源:研学Biotech 点击次数:111抗体偶联药物(ADC)作为靶向肿瘤治疗的革命性突破,正迅速成为肿瘤药物研发的主流方向。ADC通过将高特异性单克隆抗体与强效细胞毒性药物精准连接,实现了对肿瘤细胞的“精准打击”,在提高疗效的同时显著降低了传统化疗的全身毒性。然而,ADC的研发复杂性远超传统抗体药物,其成功不仅取决于细胞毒性载荷和连接子的选择,治疗性抗体的系统化筛选与优化更是决定ADC临床成败的关键环节。
今天为大家解读一篇关于ADC药物Antibody相关的文章。深入剖析ADC Antibody选择的完整策略体系,涵盖从靶点发现到抗体工程化的全流程,以期为大家在ADC药物Antibody的设计与临床开发提供系统性的方法论指参考。

一、靶点选择策略:从生物学特性到临床可开发性
1.1 靶点优先 vs. 抗体优先:两种研发路径的深度解析
选择适当的靶点可能是ADC开发项目成功的最重要考量。ADC的靶点选择可分为两种主要方法:靶点优先和抗体优先,或无偏(盲选)方法(图1)。
靶点优先策略
- 核心逻辑:基于对疾病生物学的深入理解,预先选择具有明确肿瘤特异性、内化能力和治疗潜力的靶点。
- 筛选维度:
- 表达特异性:在肿瘤组织中高表达,在关键正常组织中低表达或不表达
- 内化效率:能够高效介导抗体-抗原复合物的细胞内吞
- 肿瘤生物学功能:参与肿瘤生长、存活或转移的关键通路
- 临床可验证性:存在可用的伴随诊断工具或生物标志物
- 优势:靶点生物学意义明确,成药性评估更充分,知识产权布局更清晰
- 挑战:需要大量前期生物学验证,抗体开发周期较长
抗体优先策略
- 核心逻辑:通过功能性筛选直接获得能够结合并内化至肿瘤细胞的抗体,再反向鉴定其作用靶点。
- 技术方法:
- 全细胞免疫筛选:使用肿瘤细胞或肿瘤组织作为免疫原
- 噬菌体展示技术:在细胞水平直接筛选内化性抗体
- B细胞克隆技术:从患者或免疫动物中直接分离抗体分泌细胞
- 优势:快速获得功能性抗体,可发现新的、未预期的靶点
- 局限:容易偏向高丰度表面抗原,靶点鉴定存在技术挑战

图1. 靶点优先与无预设策略的抗体开发路径
1.2 多组学驱动的靶点发现与验证体系
大多数用于识别适合ADC方法的靶点的策略类似于为其他肿瘤生物治疗方法识别肿瘤相关细胞表面抗原的策略,但有一些显著差异。用毒素或细胞毒性有效载荷武装抗体或抗体片段的ADC概念依赖于抗体对靶点抗原的选择性,以提高疗效,同时与非靶向递送相比降低毒性。因此,理想的ADC靶点在肿瘤细胞中高度表达,在正常组织中最小表达。已采用多种方法来识别差异表达的蛋白质。通常,这涉及将肿瘤样本(组织活检、肿瘤细胞系、患者来源的异种移植物等)与密切相关的非肿瘤细胞进行比较。可以在DNA、mRNA或蛋白质水平上使用基因组学(例如CSH和FISH)、转录组学(微阵列)和/或蛋白质组学技术(2DE/MS,ICAT)进行比较。
基因组学层面
- 拷贝数变异分析:识别在肿瘤中扩增的基因区域;
- 融合基因检测:发现肿瘤特异性融合蛋白;
- 突变谱分析:寻找驱动性突变产生的肿瘤新抗原。
转录组学层面
- RNA-seq分析:系统比较肿瘤vs正常组织的基因表达差异;
- 单细胞测序:解析肿瘤微环境中不同细胞亚群的靶点表达异质性;
- 空间转录组:保留组织空间信息的靶点表达定位。
蛋白质组学层面
- 质谱分析:直接检测细胞表面蛋白质的表达丰度;
- 磷酸化蛋白质组:识别信号通路激活相关的靶点;
- 糖基化组学:发现肿瘤特异性糖基化修饰。
1.3 靶点验证的关键实验体系

二、抗体特性优化:在亲和力、渗透性与稳定性间寻找平衡
2.1 亲和力优化的科学原理:超越“越高越好”的传统观念
除了仔细选择肿瘤特异性抗原外,抗体的特性(如亲和力和分子大小)也将对ADC的疗效产生重大影响。虽然高亲和力抗体通常在筛选中脱颖而出,但值得注意的是,高亲和力并不总是与高效力相关,因为结合快速内化靶点的高亲和力抗体可能会迅速从循环中消除。高亲和力还可能由于与首次遇到的细胞紧密结合和/或快速内化,从而降低抗体深入肿瘤内部的能力,这种现象称为结合位点屏障。
亲和力与肿瘤渗透的动力学平衡
高亲和力抗体(KD < 1 nM)面临“结合位点屏障”效应:
- 在肿瘤血管周围被快速结合和内化;
- 难以渗透至远离血管的肿瘤区域;
- 导致肿瘤内部药物分布不均。
中等亲和力抗体(KD ~10-100 nM)的优势:
- 允许一定程度的解离和再结合;
- 促进抗体在肿瘤组织中的深层渗透;
- 在靶细胞上保持足够的停留时间。
亲和力与内化速率的定量关系
根据Rudnick等人的研究,抗体能否避免过早内化的关键参数是:
k_off快的抗体:在细胞表面停留时间短,有更多机会渗透至深层肿瘤区域。
k_off慢的抗体:被快速内化降解,渗透能力有限。
2.2 抗体分子大小的工程化策略
不同大小抗体的药代动力学特征比较

物种交叉反应性也是许多抗体发现项目中的一个实际考虑因素,并且由于毒理学研究的复杂性,对ADC开发尤为重要。将靶氨基酸序列与其他物种中的直系同源物进行比对,有助于确定人与其他物种(如非人灵长类或啮齿类动物靶点)之间的同一性或同源性。
2.3 pH依赖性结合工程:精准控制抗体-抗原相互作用的时空特性
pH依赖性是通过在抗体/抗原结合界面处或附近引入组氨酸残基来实现的。这些组氨酸残基在pH<6.0时质子化,在pH>6.0时去质子化,如果放置正确,可以在不同pH环境中对结合亲和力产生深远影响。
工程技术原理
- 组氨酸工程化:在抗体互补决定区(CDR)引入组氨酸残基;
- pH敏感机制:组氨酸在酸性环境(pH<6.0)中质子化,改变抗体-抗原结合界面;
- 应用优势:
- 在循环系统(pH 7.4)保持高亲和力;
- 在内吞体/溶酶体(pH 5.0-6.5)中快速解离;
- 促进毒素在细胞内的有效释放。
设计考虑
- 组氨酸的精确位置和数量需要精细优化
- 需平衡pH敏感性与靶点结合亲和力
- 需验证在肿瘤微环境(通常偏酸性)中的结合特性
工程化Fc介导的相互作用
在癌症治疗中,Fc介导的效应功能占据了非偶联单克隆抗体赋予的大部分体内效力。然而,Fc效应功能在临床上ADC抑制肿瘤生长中的作用仍不清楚。已采用多种策略来增强非偶联mAb的免疫介导效应功能,包括岩藻糖基化缺失以及抗体Fc区的突变,两者都可以增强FcγR结合并放大抗体依赖性细胞介导的细胞毒性(ADCC)。虽然这可能潜在地增加ADC的效力,但效应机制可能导致不良副作用,如交联相关的激动效应、细胞因子风暴或血小板聚集。因此,当有效载荷的靶向递送足以实现抗肿瘤活性时,效应功能可能并不理想。
三、先进抗体筛选技术平台
3.1 高通量内化筛选技术体系
荧光标记法技术流程
实验步骤:
- 抗体标记:使用NHS-SS-biotin或直接荧光标记;
- 低温结合:4°C孵育防止内化;
- 温度转换:转移至37°C启动内化;
- 表面去除:低pH缓冲液或还原剂去除表面抗体;
- 定量分析:流式细胞术或高内涵成像。
技术优势:
- 可同时评估数百个抗体
- 提供定量内化速率数据
- 兼容多种肿瘤细胞系
毒素递送功能筛选
皂草素(Saporin)偶联系统:
敏感性:可检测中等亲和力抗体的内化功能
通量:适合中等规模筛选(数百至上千个抗体)
小分子毒素偶联系统:
- MMAE/MMAF偶联二抗:灵敏度提高10-100倍
- 直接小规模偶联:Lyon等人建立的96孔板偶联方法。

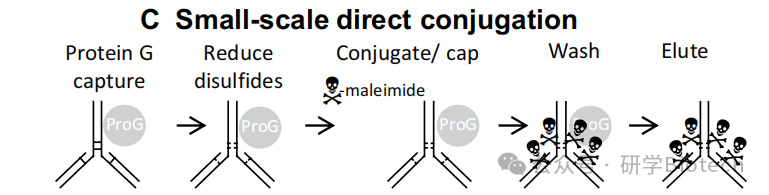
图2.内化抗体的筛选。(a) 基于荧光技术的内化筛选方法。在荧光检测中,靶细胞可在4°C条件下与抗体结合,随后升温至37°C以促进内化,经洗涤去除细胞外抗体后,采用荧光二抗固定并染色,从而显影内化的抗体。
3.2 噬菌体展示技术的创新应用
噬菌体展示已被用于识别针对各种肿瘤细胞系、原发肿瘤、肿瘤组织切片、激光捕获显微切割捕获的细胞,甚至癌症患者原发肿瘤(后者在肿瘤手术前几小时注射噬菌体)的表面抗原的抗体组。为了识别肿瘤特异性抗体,文库通常暴露于非靶标携带细胞(例如,非癌细胞系、来自同一组织的正常细胞、来自同一组织的不同癌症类型等),以去除针对常见抗原的抗体,尽管这一步通常在肿瘤细胞上进行初始轮次选择后应用,以避免耗尽稀有抗体。分离结合肿瘤细胞的噬菌体的方法包括简单的洗涤和用标准低pH和高pH缓冲液洗脱、通过有机溶剂离心分离细胞与未结合的噬菌体,以及内化选择。
内化性噬菌体筛选策略
技术优化方向
- 多价展示:提高低亲和力克隆的回收率;
- 负向筛选:使用正常细胞去除非特异性结合;
- 内化增强:使用工程化促进内化的展示系统。
传统杂交瘤技术虽然效率有限,但仍是许多上市ADC抗体的来源。近年发展的B细胞直接筛选技术通过流式分选抗原特异性B细胞并结合单细胞PCR,大大缩短了抗体发现周期。转基因动物平台能够产生全人源抗体,但免疫应答较弱且成本较高,需权衡使用。
针对难表达靶点,DNA免疫技术显示出独特优势,尤其对GPCR、离子通道等传统难靶点有效。快速免疫(RIMMS)方法通过短时间、多位点免疫策略,快速诱导B细胞应答,显著缩短抗体开发时间。
3.3 噬菌体展示优化策略
噬菌体展示生成的抗体通常具有中等亲和力(KD 1-100 nM),这种特性反而有利于肿瘤渗透,避免“结合位点屏障”效应。最佳筛选策略采用交替使用纯化抗原和完整细胞进行多轮淘选,提高抗体在天然细胞环境中识别靶点的可靠性。关键步骤是将筛选到的scFv/Fab片段转换为完整的IgG格式,以验证其最终的功能特性。
关键筛选策略总结
- 多参数并行评估:结合亲和力、内化速率、细胞内定位和功能性毒素递送等多个维度;
- 生理相关性优先:优先使用天然肿瘤细胞而非过表达细胞系进行验证;
- 早期ADC样评估:在抗体选择阶段就进行小规模偶联和功能测试;
- 高内涵技术应用:利用自动化成像系统实现高通量、多参数的内化分析。
四、定点偶联技术:从随机化学到精准偶联
4.1 传统偶联方法的局限性
赖氨酸偶联
- 异质性问题:每个抗体携带0-8个药物分子;
- 批次间差异:生产一致性挑战大;
- 结合界面干扰:可能影响抗原结合。
半胱氨酸偶联
- 二硫键还原:可能影响抗体稳定性;
- 偶联位点有限:通常为4或8个位点;
- 不完全偶联:产生未偶联抗体杂质。
4.2 新一代定点偶联技术对比

4.3 定点偶联ADC的潜在优势
药代动力学改善
- 均一性提高:批次间一致性显著改善;
- 清除率降低:避免高DAR物种的快速清除;
- 稳定性增强:减少体内药物脱落。
疗效与安全性平衡
- 治疗指数优化:通过控制DAR最大化疗效窗口;
- 毒性可预测性:代谢产物更均一,毒性更可控;
- 剂量灵活性:可根据需要调整DAR值。
更多定点偶联技术可参阅以下文章:
ADC定点偶联技术之酶介导偶联
ADC定点偶联技术之工程化半胱氨酸偶联
ADC定点偶联技术之二硫键桥连(ThioBridge)
ADC定点偶联技术之糖基偶联
五、ADC研发的未来趋势与挑战
5.1 克服实体瘤递送屏障
肿瘤微环境适应性设计
- 基质降解酶:偶联透明质酸酶等改善渗透;
- 血管正常化策略:联合抗血管生成药物;
- 免疫微环境调节:增强ADC的免疫激活效应。
新型载体系统开发
- 纳米颗粒偶联:改善肿瘤富集和滞留;
- 条件激活型ADC:仅在肿瘤微环境释放药物;
- 双特异性ADC:同时靶向肿瘤细胞和基质细胞。
5.2 伴随诊断一体化开发
早期整合策略
- 靶点表达检测:IHC、FISH、液体活检;
- 患者分层标志物:内化效率、脱落水平、代谢酶表达;
- 疗效预测模型:整合多组学数据建立预测算法。
技术平台创新
- 数字病理+AI:自动量化靶点表达和异质性;
- 液体活检动态监测:治疗过程中靶点变化追踪;
- 分子成像技术:无创评估ADC体内分布。
5.3 下一代ADC技术平台
智能响应型ADC
- 蛋白酶激活:利用肿瘤高表达的基质金属蛋白酶
- pH响应释放:肿瘤微环境特异性药物释放
- 还原敏感连接子:细胞内高谷胱甘肽环境触发释放
多功能ADC
- 免疫调节型ADC:同时递送毒素和免疫调节剂
- 双载荷ADC:针对不同细胞周期阶段的组合毒素
- ADC联合细胞治疗:增强CAR-T等疗法的实体瘤疗效
六、ADC抗体选择的系统化决策框架
阶段一:靶点评估与验证(6-12个月)
- 组学筛选:识别差异表达靶点;
- 生物学验证:确认肿瘤依赖性和内化能力;
- 可成药性评估:表达丰度、脱落特性、种属交叉;
- 专利与竞品分析:FTO检索和竞争格局评估。
阶段二:抗体产生与初步筛选(3-6个月)
- 免疫策略选择:重组蛋白、细胞免疫、DNA免疫;
- 高通量筛选:结合、内化、交叉反应性;
- 初步成药性:表达水平、稳定性、聚集倾向。
阶段三:抗体工程化与优化(6-9个月)
- 亲和力成熟:定向进化或结构指导设计;
- 功能工程化:Fc效应功能、pH敏感性、半衰期延长;
- 可开发性优化:降低免疫原性、改善稳定性。
阶段四:ADC构建与功能验证(6-9个月)
- 连接子-载荷选择:基于靶点内化特性和毒素机制;
- 偶联方法优化:DAR控制、位点特异性、工艺开发;
- 体外功能验证:细胞毒性、内化效率、旁杀效应;
- 体内药效评估:PDX模型、耐药模型、联合治疗。
阶段五:转化研究与临床开发准备(12-18个月)
- PK/PD建模:剂量预测和给药方案优化;
- 毒理学评估:种属选择、安全窗确定;
- 伴随诊断开发:分析方法验证和临床cut-off值确定;
- CMC开发:工艺放大、分析方法、稳定性研究。
七、结论
ADC药物的成功开发是一个高度复杂、多学科交叉的系统工程。治疗性抗体的选择不应仅基于传统的亲和力指标,而应建立在对靶点生物学、肿瘤微环境、药物代谢动力学和毒性特征的全面理解基础上。随着抗体工程、偶联化学和肿瘤生物学的不断进步,我们正迎来ADC研发的新时代:
精准化——从随机偶联到定点控制的化学精度;
智能化——从固定设计到环境响应的动态调控;
整合化——从单一疗法到联合治疗的系统方案;
个体化——从通用治疗到精准分层的个体医疗。
未来成功的ADC开发者需要具备跨学科的系统思维,整合生物学、化学、药学和临床医学的最新进展,在疗效、安全性和可开发性之间找到最佳平衡点。随着技术的不断成熟和临床经验的积累,ADC有望在更广泛的肿瘤类型中实现突破,最终改善更多患者的生存预后

