快速集成总膳食纤维检测试剂盒使用说明书
2025-03-21 来源:本站 点击次数:1582
快速全组分总膳食纤维检测程序(包括抗性淀粉和不可消化的寡糖)K-RINTDF (100次/盒)
AOAC方法2017.16 国际谷物科技协会标准草案185
AOAC方法2017.16 国际谷物科技协会标准草案185
产品简介:
国际食品法典委员会(CAC)于 2009 年 6 月 1通过的膳食纤维定义包括不会被人类小肠中的内源酶水解的碳水化合物聚合物,因此也包括抗性淀粉(RS)。
这一定义还包括聚合度为 3~9 的寡糖,但是否将这些寡糖纳入膳食纤维测定值由每个国家当局决定。
2007 年发布了一种为支持国际食品法典委员会定义而设计的方法 2,成功通过实验室间评估 3,4,并获得美国官定分析化学家协会(AOAC)批准(方法编号为 2009.01;2011.25)3-5。AOAC 方法 2009.01 可测定总膳食纤维,所测膳食纤维类型包括高分子量膳食纤维(HMWDF)(不溶性膳食纤维(IDF)和不溶于78%乙醇溶液的、可沉淀的可溶性膳食纤维(SDFP))与可溶于 78%乙醇溶液的、不可沉淀的可溶性膳食纤维(SDFS)。在过去 8 年里,这一方法被广泛应用于食品和原料检测,并揭示了其面临的诸多挑战/问题:
a) 胰 α-淀粉酶+淀粉葡萄糖苷酶(PAA+AMG)孵育时间长达 16 小时(与用于测定抗性淀粉的 AOAC 方法 2002.02 的孵育条件一致))4,6,没有生理学依据。食物在小肠中的停留时间一般只有 3 至 5 小时 7-9。
b) 市面上出售的大多数低聚果糖(FOS)中都含有菊三糖(果糖基-β-(2-1)-果糖基-β-(2-1)-果糖),其会随二糖组分一起被洗脱,无法被 WatersSugar-Pak®高效液相色谱柱测定为膳食纤维。
c) 在 AOAC 方法 2009.01 的孵育条件下,非抗性淀粉水解时会有抗性麦芽糊精生成,被误测为膳食纤维 8,10,11。
d) PAA/AMG 孵育时间过长,造成样品过度水解,导致磷酸酯交联淀粉(RS4,例Fibersym®)12测定结果低于实际值。
e) 出于对检测人员健康的考虑,不宜使用防腐剂叠氮化钠。
在下图(图 1)介绍的“快速”全组分总膳食纤维检测(RINTDF)流程中,AOAC 方法 2009.01 和 2011.25 面临的各项挑战和局限性都已得到解决 8。使用更高浓度的 PAA 和 AMG 进行孵育可防止抗性麦芽糊精的生成(图 2)。缩短孵育时间,与生理条件一致,可提高 Fibersym®(RS4)和 Hylon VII®(高直链玉米淀粉)的膳食纤维测定值(表 1)。用 TOSOH TSKgel®G2500PWXL 凝胶渗透色谱柱 13替换 Waters Sugar-Pak®色谱柱解决了 F3 色谱分析的问题(图 3)。缩短孵育时间后,无需在孵育缓冲液中添加叠氮化钠。此外,RINTDF 使用更高浓度的 PAA 和 AMG 进行孵育,除低聚异麦芽糖之外,所有不可消化的寡糖的 SDFS 测定值与 AOAC 方法 2009.01 测得的结果相同(表 2)。用试管中的树脂对样品中的大部分盐分进行脱盐处理,然后使用 Bio-Rad 的 HPLC 去离子预柱实现完全去离子,HPLC 的样品制备也得以简化。

在下图(图 1)介绍的“快速”全组分总膳食纤维检测(RINTDF)流程中,AOAC 方法 2009.01 和 2011.25 面临的各项挑战和局限性都已得到解决 8。使用更高浓度的 PAA 和 AMG 进行孵育可防止抗性麦芽糊精的生成(图 2)。缩短孵育时间,与生理条件一致,可提高 Fibersym®(RS4)和 Hylon VII®(高直链玉米淀粉)的膳食纤维测定值(表 1)。用 TOSOH TSKgel®G2500PWXL 凝胶渗透色谱柱 13替换 Waters Sugar-Pak®色谱柱解决了 F3 色谱分析的问题(图 3)。缩短孵育时间后,无需在孵育缓冲液中添加叠氮化钠。此外,RINTDF 使用更高浓度的 PAA 和 AMG 进行孵育,除低聚异麦芽糖之外,所有不可消化的寡糖的 SDFS 测定值与 AOAC 方法 2009.01 测得的结果相同(表 2)。用试管中的树脂对样品中的大部分盐分进行脱盐处理,然后使用 Bio-Rad 的 HPLC 去离子预柱实现完全去离子,HPLC 的样品制备也得以简化。

图 1:AOAC 方法 2009.01 和 2017.16 的总膳食纤维检测流程。
 图 2:根据 AOAC 方法 2009.01 和 2017.16 进行孵育后的“Uncle Ben’s ReadyRice”中的SDFS 组分在 TSKgel® G2500PWXL色谱柱上生成的高效液相色谱图。
图 2:根据 AOAC 方法 2009.01 和 2017.16 进行孵育后的“Uncle Ben’s ReadyRice”中的SDFS 组分在 TSKgel® G2500PWXL色谱柱上生成的高效液相色谱图。
 图 2:根据 AOAC 方法 2009.01 和 2017.16 进行孵育后的“Uncle Ben’s ReadyRice”中的SDFS 组分在 TSKgel® G2500PWXL色谱柱上生成的高效液相色谱图。
图 2:根据 AOAC 方法 2009.01 和 2017.16 进行孵育后的“Uncle Ben’s ReadyRice”中的SDFS 组分在 TSKgel® G2500PWXL色谱柱上生成的高效液相色谱图。请注意,根据 AOAC 方法 2009.01 进行孵育后的 SDFS 中存在七糖,而根据AOAC 方法 2017.16 进行孵育后的 SDFS 中不存在七糖。
表 1:比较使用 AOAC 方法 2009.01(全组分总膳食纤维检测程序)和 AOAC方法 2017.16(RINTDF 检测程序)检测一系列样品测得的总膳食纤维值。

表 2:原始样品以及依照 AOAC 方法 2009.01 和 AOAC 方法 2017.16(RINTDF检测程序)进行孵育后的样品中的 DP≥3 的寡糖回收率。

*一种菊粉三糖含量较高的 Raftilose P-95 样品。


表 2:原始样品以及依照 AOAC 方法 2009.01 和 AOAC 方法 2017.16(RINTDF检测程序)进行孵育后的样品中的 DP≥3 的寡糖回收率。

*一种菊粉三糖含量较高的 Raftilose P-95 样品。

图 3:依照 RINTDF 程序对 200mg Raftilose P-95 和 100mg 丙三醇进行孵育后所得 SDFS 组分在 TSKgel® G2500PWXL色谱柱上生成的 HPLC 色谱图。

A. 原理:

A. 原理:
本手册介绍了一种用于测定所有食品和食品原料中总膳食纤维(包括 DP≥3 的抗性淀粉SDFP(即不可消化的寡糖))的快速全组分检测程序(RINTDF)。RINTDF 结合了 AOAC 官方方法2002.02、985.29、991.43、2001.03 和 2009.01的关键属性。将两份检样分别置于 250mL 密封瓶中,在胰 α-淀粉酶(PAA)和淀粉葡萄糖苷酶(AMG)的作用下,37°C 下搅拌或振荡孵育 4 个小时(图 4 和图 5,第 19 页)。在这一步骤中,非抗性淀粉被溶解并水解成 D-葡萄糖和痕量的麦芽糖。将 pH 值调节至 8.2(AMG 无活性),然后将孵育混合物加热至 95℃左右,使 AMG 和 PAA 失活,从而终止反应。样品中的蛋白质变性,并被蛋白酶水解。特定膳食纤维组分的测定方法如下:
i. 总高分子量膳食纤维(HMWDF)和 SDFS 的测定向孵育混合物中加入 4 倍体积的 95%乙醇并搅拌,孵育混合物中的 SDFP 形成沉淀,然后对悬浮液进行过滤。将在坩埚中回收的 HMWDF(由不溶性膳食纤维(IDF)和 SDFP 组成)洗涤、干燥并称重。用蛋白质、灰分和空白值对残渣质量进行修正后,进行最终计算。将过滤后的清液浓缩、去离子处理后,用HPLC 法分析 SDFS。
设备要求:
ii. 不溶性膳食纤维(IDF)、SDFP 和 SDFS 的测定
将孵育混合物水溶液进行过滤,以回收 IDF,并对滤渣进行洗涤、干燥和称量。使用酒精或工业基化酒精(IMS)沉淀滤液中的 SDFP,然后对沉淀物进行回收、干燥并称重。用蛋白质、灰分和空白值对 IDF 和 SDFP 残渣质量进行修正,并最终计算 IDF 和 SDFP 的质量。已沉淀并去除 SDFP 的乙醇溶液滤液(即含SDFS 的滤液),依次经过浓缩和去离子处理后,用 HPLC 法进行分析。这些方法中使用的酶纯度非常高;不含可分解 β-葡聚糖、果胶和阿拉伯木聚糖的杂质酶(表 3)。低聚果糖和低聚半乳糖等不可消化的寡糖(NDO)不会被水解(表 2),Polydextrose®的水解度与供应商提供的信息一致。
表 3:分析质控样品,以确保使用的酶活力合适,且不存在杂酶活力(质控样品可在 Megazyme 的 K-TDFC 试剂盒中获取)。对照分析应贯穿整个检测程序。

4 号瓶:(x2)
5 号瓶:

a . 检测过程中不应存在这一酶活力。
b . 检测过程中,这一酶活力应当充分发挥作用。
c . 造成数值较低的主要原因是样品中的水分含量。在孵育过程中不添加酶的情况下,也可获得相近数值。
d . .这类物质含有大量抗酶解淀粉。这一膳食纤维值高于 AOAC 方法 991.43 的测定值(29.3%)。
试剂盒:
1 号瓶:(×2)
纯化 PAA(40 KU/g)和 AMG(17 KU/g)混合物;5.2g。储存在低于-10℃的干燥环境下可稳定 5 年以上。
注意:粉末状的酶混合物可能导致一些人严重过敏。因此,酶混合物的称重和处理必须在通风柜中进行;请参[C(d)]。
2 号瓶:
纯化蛋白酶(E-BSPAMS)(10.5 mL 3.2 M 硫酸铵溶液,350 酪氨酸 U/mL)。在 4℃下可稳定 3 年以上。
3 号瓶:
液相色谱保留时间标准品【麦芽糊精与麦芽糖(比例4:1)】,约 5 g。
可稳定 3 年以上;应置于室温下密封保存。
4 号瓶:(x2)
丙三醇标准溶液(100 mg/mL,55 mL)。
在 4°C 下可稳定 4 年以上;应置于 4°C 下密封保存。
5 号瓶:
D- 葡萄糖 / 丙三醇( Glu/Gly )标准溶液(均为 10mg/mL,溶解于 0.02%(w/v)叠氮化钠中)。在 4 °C下可稳定 4 年以上;应置于 4 °C 下密封保存。
B.
设备要求:
a. 磨碎机——离心磨碎机,12 齿转子,筛网孔径为 0.5 mm,或类似设备。作为替代方案,小剂量实验室试样也可使用旋风磨碎机磨碎,前提是磨碎机气流充足或者采用其他冷却措施来避免样品过热。
b. 消化瓶——250 mL Fisherbrand®苏打玻璃宽口瓶,聚乙烯瓶盖(货号:FB73219)。
c. 烧结玻璃坩埚——古氏玻璃坩埚,烧结底盘,Pyrex® 50 mL,大孔径,美国材料与试验协会(ASTM)40-60 mm,Corning®型号 32940-50C。
依照以下步骤为每个样品准备四个坩埚:
i. 将坩埚在马弗炉中 525 ℃灼烧过夜,将马弗炉冷却至 130 ℃,取出坩埚,避免坩埚破裂。
ii. 使用真空抽力,清除任何残留的 Celite®硅藻土和灰分。
iii. 将坩埚置于 2 %的清洁溶液[C(o)]中,室温浸泡 1 小时。
iv. 用水和去离子水冲洗坩埚。
v. 最后用 15 mL 丙酮冲洗坩埚,空气干燥。
vi. 在已干燥的坩埚中加入约 1.0 g Celite®硅藻土,并在 130 ℃下干燥至恒重。
vii. 将坩埚置于干燥器中冷却约 1 小时,记录装有 Celite®硅藻土的坩埚质量。
d. 过滤烧瓶——1 L 厚壁布氏侧臂烧瓶(图 6,第 19 页)。
e. 橡胶环连接器——用于连接坩埚和过滤烧瓶(图 6,第 19 页)。
d. 过滤烧瓶——1 L 厚壁布氏侧臂烧瓶(图 6,第 19 页)。
e. 橡胶环连接器——用于连接坩埚和过滤烧瓶(图 6,第 19 页)。
f. 真空源——真空泵或可调节真空度的抽气机(例如,Edwards XDS 10;单相 115/230V;产品代码:A726-01-903)。
g. 水浴装置——在浸入式热水浴(例如 Lauda Alpha®)中,放置一个 2 mag Mixdrive 15®潜水式磁力搅拌器,用 30×7 mm 搅拌子以 170 rpm 转速搅拌(图 4,第 19 页)。或可采用大容量(20-24 L)带盖振荡水浴槽(150rpm),温度可维持在 37±1 °C 和 60±1 °C(例如 Grant® OLS 200 振荡水浴槽)(图 5,第 19 页)。
h. 天平——最小分度值、准确度和精度均为 0.1 mg。
i. 烘箱——两台机械对流式烘箱,温度设定为 105±2 ℃和 130±3 ℃。
j. 计时器。
k. 干燥器——气密干燥器,装有硅胶或等效干燥剂。每两周将干燥剂置于烘
箱中在 130℃下干燥过夜。
l. pH 计。
m. 正位移移液器——例如 Eppendorf Multipette®-带 25 mL Combitip®移液管(用于移取 5 mL PAA/AMG 溶液,3 mL 0.75 MTris 碱溶液和 4 mL 2M 乙酸溶液)。
-带 5.0 mL Combitip®移液管(用于移取 0.1 mL 蛋白酶溶液)。
n. 分液器——用于移取 15±0.5 mL 78%(v/v)乙醇(或 IMS)、95%(v/v)乙醇、丙酮,以及 35±0.2 mL 缓冲液。
o. 量筒——100 mL 和 500 mL 刻度量筒。
p. 磁 力 搅 拌 器 和 搅 拌 子 ——7×30 mm , 光滑表面磁力搅拌子 , VWR International,型号 442-0269。
q. 橡胶刮刀——VWR International,型号 53801-008(图 6,第 19 页)。
r. 马弗炉——525±5 °C。
s. 聚 丙 烯 试 管 ——Sarstedt 聚丙烯试管 , 13 mL , 101×16.5 mm ( 型 号 60.541.685)。
t. 液相色谱仪——烘箱可将柱温维持在 80 ℃,配 50 μL 进样环。液相系统必须能够分离麦芽糖和麦芽三糖。
u. 保护柱(或预柱)——TSK®保护柱 PWXL 6.0 mm 内径×4 cm(Tosoh Corp.,型号 TSKgel® G2500PWXL)。
v. 阳离子和阴离子交换保护柱(去离子柱)——阳离子和阴离子交换保护柱,分别为 H +和 CO2 3-型(Bio-Rad Laboratories,型号 125-0118,包括一个阳离子柱和一个阴离子柱),以及一个保护柱支架(Bio-Rad Laboratories,型号125-0139),以支撑两个保护柱,阳离子柱在前,阴离子柱在后[14](图 7,第 19 页)。
w. 液相色谱柱——两个串联的液相色谱柱。TSKgel® G2500PWXL,7.8 mm 内径×30 cm(Tosoh Corp);流速为 0.5 mL/min;柱温 80 ℃;运行时间为 60分钟,以确保样品全部流出色谱柱(图 8,第 20 页)。
x. 检测器——折光率(RI)检测器;温度维持在 50 ℃。
y. 数据集成器或计算机——用于测量峰面积。
z. 一次性注射器的滤膜——Millipore Millex®针头式过滤器,孔径为 0.45 μm(低蛋白结合 Durapore PVDF 滤膜),直径为 25 或 13 mm,或其它等效滤膜。
aa. 滤水滤膜——Millipore,孔径 0.45 μm 的 Durapore® HVLP 型滤膜,直径为47 mm。
bb. 过滤装置——支持直径为 47 mm、孔径为 0.45 μm 的滤膜[B(aa)];可并过滤更大量的水。
cc. 注射器——一次性 10 mL 塑料注射器。
dd.. 液相色谱上样针——Hamilton® 100 μL 710SNR 上样针。
ee. 旋转蒸发器——Heidolph Laborota® 4000 型或等效仪器。
ff. 微量离心机——转速可达 13000 rpm。
gg. 温度计——最高测量温度至少为 110 °C。
试剂:
C.
试剂:
a. 乙醇(或 IMS)95%(v/v)。
b. 乙醇(或 IMS)78%(v/v)——将 180 mL 去离子水倒入一个 1 L 的容量瓶中。用 95%(v/v)乙醇(或 IMS)稀释定容至刻度线,搅拌均匀。
c. 丙酮,试剂级。
d. PAA/AMG 储备液——PAA(4 KU/5mL)和 AMG(1.7 KU/5mL)。将 1.0g PAA/AMG 粉末混合物(1 号瓶,第 6 页)添加至 50 mL 马来酸钠缓冲液[C(g)]中,在磁力搅拌器上搅拌 5 分钟,临用现配。使用时置于冰上,并于制备后 4 小时内使用。
注意 1:如果分析员对粉末状 PAA 和/或 AMG 过敏,应由一位对粉末混合物不过敏的分析员按照以下步骤将酶粉制备为硫酸铵悬浮液:将 5 gPAA/AMG 粉末混合物(PAA 40 KU/g 和 AMG 17 KU/g,1 号瓶,第 6 页)缓慢添加至装有 70 mL 冷蒸馏水的 200 mL 烧杯中,置于通风柜中磁力搅拌,直至酶粉完全溶解(约 5 分钟)。
加入 35 g 颗粒硫酸铵,搅拌溶解。用硫酸铵溶液(50 g/100 mL)定容至100 mL。在 4 ℃下可稳定 3 个月。
e. 溶解于 3.2M 硫酸铵溶液中的蛋白酶(50 mg/mL;350 酪氨酸 U/mL)——直接使用 2 号瓶(第 6 页)内容物。使用前轻轻旋动内容物,使悬浮物质均匀分布。蛋白酶必须不含 α-淀粉酶,基本不含 β-葡聚糖酶和 β-木聚糖酶。使用时置于冰上。在 4℃下可稳定 3 年以上。
f. 去离子水。
g. 马来酸钠缓冲液——50 mM、pH 6.0 加上 2 mM CaCl2。将 11.6 g 马来酸溶解于 1600 mL 去离子水中,用 4 M(160 g/L)NaOH 溶液调节 pH 至 6.0。加入 0.6 g 二水氯化钙(CaCl2.2H2O),溶解并定容至 2 L。将溶液保存在密封良好的 Duran®瓶中,加入两滴甲苯以防止微生物污染。在 4 °C 下可稳定约 1 年。
h. 0.7 5M Tris 溶液——将 90.8 g Tris 缓冲盐(Megazyme 货号 B-TRIS500)溶解于约 800 mL 去离子水中。将 pH 值调节至 11,并定容至 1 L。室温下可稳定约 1 年。
i. 2 M 乙酸溶液——将 115 mL 冰乙酸(Sigma W200611-1KG-K)加入到 1 L的容量瓶中。用去离子水稀释定容至 1 L。室温下可稳定 1 年以上。
j. 叠氮化钠溶液(0.02%(w/v))——将 0.2 g 叠氮化钠添加至 1 L 去离子水中,搅拌溶解。
注意 2:不得将叠氮化钠加至低 pH 溶液中,叠氮化钠酸化会释放有毒气体。处理叠氮化钠前应仔细阅读安全数据表(SDS),使用时应穿戴适当的个人防护设备,在实验室通风柜中小心处理。
室温下可稳定 4 年以上。
k. 用于测定 HPLC 响应因子的 D-葡萄糖/丙三醇标准溶液——均为 10 mg/mL,溶液为 0.02%(w/v)叠氮化钠。直接使用 5 号瓶(第 6 页)内容物。
在 4 ℃下可稳定 4 年以上。
l. 丙三醇(TSK®凝胶渗透色谱柱内标物)——100 mg/mL,含 0.02%(w/v)叠氮化钠。直接使用 4 号瓶内容物(第 6 页)。
在 4 ℃下可稳定 4 年以上。
m. 液相色谱保留时间标准品——标准品中玉米糖浆干粉寡糖(DP>3)(DE25;日本兵库县伊丹市松谷化学;(www.matsutani.com))与麦芽糖的比例为 4:1(w/w)。称取 2.5 g 混合物(3 号瓶,第 6 页)溶解于 80 mL 0.02 %叠氮化钠溶液中,定量转移至一个 100 mL 的容量瓶中。用移液器移取 10mL 内标物溶液[C(l)]至容量瓶中,并用 0.02 %叠氮化钠溶液[C(j)]定容至100 mL,将溶液分装到 50 mL 的聚丙烯瓶中。室温下可稳定 1 年以上;在-10°C 以下可稳定 4 年以上。
n. pH 标准液——pH 值为 4.0、7.0 和 10.0 的缓冲溶液。
o. 清洁溶液——Micro-90®(美国 International Products Corp.,货号 M-9033,www.ipcol.com/shopexd.asp?id=15)。用去离子水配制 2 %的清洁溶液。
p. 阳离子交换树脂——Amberlite® FPA53 (OH- )树脂(Megazyme 货号:G-AMBOH),离子交换容量不小于 1.6 meq/mL(制造商提供的 R-OH-交换容量数据)
q. 阴 离 子 交 换 树 脂 ——Ambersep®200 (H+ ) 树脂或 其 它 等 效 产 品 , (Megazyme 货号:G-AMBH),离子交换容量:不小于 1.6 meq/mL(制造商提供的 R-H+交换容量数据)。
r. Celite®硅藻土——预酸洗和预灰化处理的硅藻土(Megazyme 货号:G-CELITE)。
D.试样制备:
采集和制备的样品应当是可以直接食用的形态,例如,烘焙粉应制作成食物并烤熟,意大利面应煮熟。如果脂肪含量>10%,则应依照 AOAC 985.29 进行脱脂处理。对于含水量较高(>25%)的样品,最好是进行冷冻干燥。称取约 50 g样品置于磨碎机[B(a)]中磨碎,过 0.5 mm 筛网,将所有样品转移至一个宽口塑料罐中,通过振荡和颠倒摇晃混合均匀。加入干燥包后储存。
E. 酶纯度:
为保证不含杂酶,且获得理想的酶活力,若酶已经储存 12 个月以上,需用标准品验证酶的有效性(Megazyme 货号 K-TDFC)。
F. 样品的酶解:
(1)空白
在每组检测中,对每个样品配置两个空白,以测量试剂对残渣质量的贡献值。
(2)样品
(a) 准确称取约 1 g 样品,精确至小数点后第三位。一式两份,分别装入两个250 mL 的 Fisherbrand®玻璃瓶中[B(b)]。记录称得的质量。
(b) 添加酶——用 1.0 mL 的 95%乙醇(或 IMS)[C(a)]浸润样品,然后加入 35mL 马来酸钠缓冲液[C(g)],两瓶样品进行相同操作。盖上瓶盖,将样品瓶置于 Grant OLS 200 振荡孵育器(或类似仪器)[B(g)]中,用弹簧或聚丙烯支架将玻璃瓶固定在摇床上(图 5,第 19 页)。平衡 5 分钟,使溶液温度达到水浴温度。或者,使用一个 2 mag Mixdrive 15®浸没式磁力搅拌器[B(g)],用 7×30 mm 搅拌子[B(p)]搅拌(图 4,第 19 页)。
(c) 用 PAA/AMG 溶液孵育——加入 5 mL PAA/AMG 溶液[C(d)],盖上瓶盖,将样品瓶置于振荡水浴槽中,37℃、150rpm 振荡孵育[B(g)]4 小时整。或者使用 2 mag Mixdrive 15®浸没式磁力搅拌器以 170 rpm 转速(确保颗粒完全离底悬浮)搅拌 4 小时整。注意:若使用酶制剂的硫酸铵悬浮液[C(d)],则应添加 2 mL 酶悬浮液和 3 mL 马来酸钠缓冲液[C(g)]。
(d) 将 pH 值调节至约 8.2(pH7.9-8.4),使 α-淀粉酶和 AMG 失活——4 小时后,从振荡水浴槽中取出所有样品瓶,并立即加入 3.0 mL 的 0.75 M Tris 缓冲液[C(h)],以终止反应(同时,如果只有一个水浴槽,则应将水浴槽温度调高至 60 ℃,为蛋白酶孵育步骤做好准备)。略微拧松样品瓶瓶盖,并立即将样品瓶置于 95 ℃至 100 ℃的水浴槽中(不振荡),孵育 20 分钟,期间偶尔用手振摇。使用温度计确保样品瓶内容物的最终温度高于 90 ℃(仅检查一个样品瓶的温度即可)。
(e) 冷却——佩戴隔热手套,将所有样品瓶从沸水浴中取出,并置于 60 ℃的水浴槽中,让温度在 10 分钟内平衡至约 60 ℃。
(f) 蛋白酶处理——用正位移液器加入 0.1 mL 蛋白酶悬液(2 号瓶,第 6 页)[C(e)](溶液较为粘稠),60 ℃孵育 30 分钟。
(g) 调节 pH——向两个样品瓶中分别加入 4.0 mL 的 2M 乙酸[C(i)]并混合均匀,以调节 pH 值。最终 pH 值约为 4.3。
(h) 内标物——分别加入两个样品瓶中加入 1.0 mL 丙三醇内标物溶液(100mg/mL;4 号瓶,第 6 页)[C(l)],并混合均匀。
(i) 执行步骤[G(a)]以测定 HMWDF(IDF+SDFP),或者执行步骤[H(a)]以测定 IDF、SDFP 和 SDFS。
注意:
如需测定可利用碳水化合物,准确转移 0.5 mL 孵育溶液至一微量离心管中,13000 rpm 离心 3 分钟。转移 0.2 mL 上清液至一 13 mL(101×16.5mm)聚丙烯试管中,并添加 5 mL 蒸馏水。盖上试管盖,于-10°C 以下保存。使用Megazyme 可利用碳水化合物测定试剂盒(K-AVCHO)进行可利用碳水化合物分析。
G. 测定 HMWDF(IDF 和 SDFP):(与 AOAC 方法 2009.01 的程序相同):
(a) 沉淀 SDFP——将样品预热至 60 ℃,加入 220 mL 95 %(v/v)乙醇或IMS[C(a)](在室温下量取,预热至 60 ℃)。混合均匀,室温沉淀 60 分钟(也可过夜沉淀)。
(b) 准备过滤——称量装有 Celite®硅藻土[B(c)]的坩埚重量,精确到 0.1 mg。用洗瓶操作,用 15 mL 78 %(v/v)乙醇或 IMS[C(b)]浸润并重新分配坩埚中的 Celite®硅藻土层。用适度的抽力将坩埚中的 Celite®硅藻土平整地分布于烧结玻璃底盘上(图 6,第 19 页),倒掉滤液。
(c) 过滤——利用真空抽力,用坩埚过滤沉淀的酶消化物[G(a)]。使用一个装有78 %(v/v)乙醇或 IMS 的洗瓶,将所有残余酶消化物定量转移至坩埚中,并用 15 mL 78 %(v/v)乙醇(或 IMS)[C(b)]洗涤残渣。保留滤液和洗液,并用 78 %乙醇定容至 300 mL,然后执行第 16 页的步骤[I(a)],以测定SDFS。
(d) 洗涤——利用真空抽力,依次用 15 mL 以下溶液洗涤残渣两次:78 %(v/v)乙醇(或 IMS)[C(b)]、95 %(v/v)乙醇(或 IMS)[C(a)]和丙酮[C(c)]。倒掉洗涤液,继续用真空泵抽至少 2 分钟,以确保在将坩埚置于烘箱干燥之前已清除所有丙酮。
(e) 干燥坩埚——将装有残渣的坩埚置于 105 ℃烘箱中,干燥过夜。若使用强风型烘箱,则应用铝箔松散覆盖住坩埚口,以防止样品损失。
(f) 将坩埚置于干燥器中冷却约 1 小时。称量坩埚重量(包含膳食纤维残渣和Celite®硅藻土),精确到 0.1 mg。将称得的质量减去坩埚和 Celite®硅藻土的质量,即得残渣质量。
(g) 蛋白质和灰分的测定——取其中一个坩埚的残渣用于分析蛋白质,另一个坩埚的残渣用于分析灰分。用凯氏定氮法(Kjeldahl)或燃烧法对残渣进行蛋白质分析(使用燃烧法分析仪时务必小心。样品中挥发出的 Celite®硅藻土可能堵塞分析仪的传输管)。在所有情况下均应使用 6.25 作为系数来计算蛋白质质量。将另一份残渣在 525 °C 马弗炉[B(r)]中灼烧 5 个小时,于干燥器中冷却,并称重至 0.1 mg,减去坩埚和 Celite®硅藻土的质量,即得灰分质量。
(h) 计算 HMWDF(IDF+SDFP)和 SDFS 质量——执行步骤[J](第 17 页)。
H. 分别测定 IDF 和 SDFP:(与 AOAC 方法 2011.25 的程序相同):
IDF
(a) 准备过滤——称量装有 Celite®硅藻土[B(c)]的坩埚重量,精确到 0.1 mg。用洗瓶操作,用 15 mL 78 %(v/v)乙醇或 IMS[C(b)]浸润并重新分配坩埚中的 Celite®硅藻土层。用适度的抽力将坩埚中的 Celite®硅藻土平整地分布于烧结玻璃底盘上(图 6,第 19 页),倒掉滤液。
(b) 过滤——利用真空抽力,用坩埚过滤步骤[F(2)(a)]的酶消化物。使用一个装有 60 ℃去离子水的洗瓶,用最少量(约 10 mL)的水冲洗孵育瓶,并使用一个橡胶棒(或铲)[B(q)]辅助转移容器内壁上的所有颗粒。将悬浮液转移至坩埚中,再次用 10 mL 60 ℃的水洗涤孵育瓶,并将悬浮液转移至坩埚中。收集滤液和洗涤液,并定容至 70 mL,用于测定 SDFP[H(f)]和 SDFS[H(g)]。
(c) 洗涤——利用真空抽力,依次用 15 mL 以下溶液洗涤残渣两次:78 %(v/v)乙醇(或 IMS)[C(b)]、95 %(v/v)乙醇(或 IMS)[C(a)]和丙酮[C(c)]。倒掉洗涤液,继续用真空泵抽至少 2 分钟,以确保在将坩埚置于烘箱干燥之前已清除所有丙酮。
(d) 干燥坩埚——将装有残渣的坩埚置于 105 ℃烘箱中,干燥过夜。
(e) 冷却坩埚和测定 IDF。冷却坩埚,并依照步骤[G(e)]至[G(f)]测定残渣质量。依照步骤[G(g)]测定蛋白质和灰分,并在残渣质量中扣除蛋白质和灰分质量。依照步骤[J]计算 IDF(请参阅注意,第 16 页)。
SDFP
(f) 沉淀 SDFP——将步骤[H(b)]获得的各个样品的滤液(约 70 mL)预热至60 ℃,并添加 320 mL 95 %(v/v)乙醇或 IMS[C(a)](在室温下量取,再预热至 60 ℃),并混合均匀。室温沉淀 60 分钟(也可过夜沉淀)。
(g) 过滤和回收 SDFP 和 SDFS——过滤悬浮液并回收残渣,分析蛋白质和灰分,并依照步骤[G(b)]至[G(g)]计算 SDFP。保存滤液和洗涤液(约 420 mL),并执行步骤[I(a)]来测定 SDFS。
I. 测定 SDFS:
注意:正确地去除溶液中的离子是获取优质色谱数据的必要条件。参阅图 9(第 20 页)以比较在存在和不存在缓冲盐的情况下,丙三醇和 D-葡萄糖生成的色谱图。为确保使用的树脂具有充分的去离子能力,将 0.1 mL 蛋白酶悬浮液(2 号瓶,第 6 页)添加至 40 mL 马来酸缓冲液[C(g)]中,并加入 3.0 mL 0.75M Tris 碱溶液[C(h)]、4.0 mL 2 M 乙酸[C(i)]、1 mL 丙三醇内标物溶液(100
mg/mL;4 号瓶,第 6 页)[C(l)]和 1 mL D-葡萄糖溶液(100 mg/mL),将混合溶液置于旋转蒸发器上蒸干,用 32 mL 去离子水中复溶。取 5 mL 该溶液至一个 13 mL 的聚丙烯试管[B(s)]中,加入 1.5 g Amberlite® FPA53(OH-)树脂和1.5g Ambersep® 200(H +)树脂(图 8,第 20 页),盖上管盖,并颠倒摇晃试管,持续 5 分钟。静置使树脂沉底,并使用注射器[B(cc)]取 1.5-2.0 mL 上清液,过 0.45 μm 聚偏氟乙烯膜[B(z)]。取 50 μL 上 TSK 色谱柱(已安装去离子预柱)。应得到类似于图 9c(第 20 页)所示的色谱图,即没有明显的盐峰。
(a) 滤液回收和浓缩——【若需两份 SDFS 数据,应将其中一份重复样品的滤液[G(c)]或[H(g)]留存备用】。取第二份重复样品的滤液[G(c)]或[H(g)]的四分之一【即~75 mL 的[G(c)]或~105 mL 的[H(g)]】,置于 500 mL 的旋转蒸发瓶,60℃下真空蒸干,用 8 mL 去离子水复溶。
(b) 样品去离子——将 5 mL 步骤[I(a)]中所得的样品浓缩液转移至一个 13 mL的聚丙烯试管[B(s)]中(样品中含丙三醇内标物,因此无须定量转移)。在试管中加入约 1.5 g Amberlite® FPA53(OH-)树脂[C(p)]和 约 1.5 gAmbersep® 200(H +)树脂[C(q)],将试管颠倒摇晃 3 至 4 分钟(图 8,第20 页)。
(c) 制备用于液相色谱分析的样品——将溶液转移至一个 10 mL 的一次性注射器[B(cc)]中,过 0.45 µm 滤膜[B(z)]。也可将 1 mL 溶液转移至微量离心管[B(ff)]中,13000 rpm 离心 3 分钟。用一个 100 μL 液相色谱玻璃上样针[B(dd)]上 50 μL 样至色谱仪[B(t)]。对样品进行一次分析便已足够。色谱柱:一根去离子预柱[B(v)]加两根 TOSOH TSK 凝胶渗透色谱柱[B(w)]。溶剂:经微滤[B(bb)]的蒸馏水。流速:0.5 mL/min;每次运行 60 分钟。温度:80 °C(图 7,第 19 页)。
(d) 测定 D-葡萄糖的响应因子——由于 D-葡萄糖的液相色谱折光率(RI)响应因子与组成 SDFS 的不可消化的寡糖的响应因子相当,因此 D-葡萄糖被用来校准液相色谱仪,其响应因子也被用于计算 SDFS 质量。用一个 100 μL液相色谱上样针将 50 μL 的 D-葡萄糖/丙三醇内标物溶液(5 号瓶,第 6 页)上样至液相色谱仪,做两个平行。依照步骤[J(b)](1)]计算响应因子。
(e) 校准用于计算 SDFS 的峰面积——用一个 100 μL 液相色谱上样针将 50 μL的保留时间标准品[C(m)](3 号瓶;第 6 页)上样至液相色谱仪,做两个平行。确定 DP2 和 DP3 寡糖(麦芽糖 vs 聚合度更高的寡糖)的分界点(图 3,第 4 页)。
(f) 确定样品提取物色谱图中 SDFS(PASDFS)和内标物(PAIS)的峰面积——将样品提取物[I(c)]上样至液相色谱仪。将 DP 高于 DP2/DP3 分界点的所有峰面积记录为 PASDFS,将内标物的峰面积记录为 PAIS。
(g) 执行步骤[J(b)(2)]。
J. 计算总膳食纤维含量:HMWDF(IDF+SDFP)+SDFS
(a) HMWDF(IDF+SDFP)(重量分析法)
(a) HMWDF(IDF+SDFP)(重量分析法)
(1) 测定空白值(B,mg)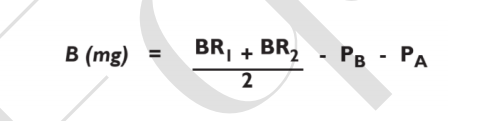

式中 BR1 和 BR2 分别为两份重复空白样测定的残渣质量(mg);PB 和 PA 为用
两份空白残渣分别测定的蛋白质和灰分质量(mg)。




 图 8:对用于 HPLC 分析的样品进行去离子处理。5 mL 浓缩洗脱液与 1.5 g Amberlite® FPA53(OH- )树脂和 1.5g Ambersep®200(H+ )树脂混合。
图 8:对用于 HPLC 分析的样品进行去离子处理。5 mL 浓缩洗脱液与 1.5 g Amberlite® FPA53(OH- )树脂和 1.5g Ambersep®200(H+ )树脂混合。
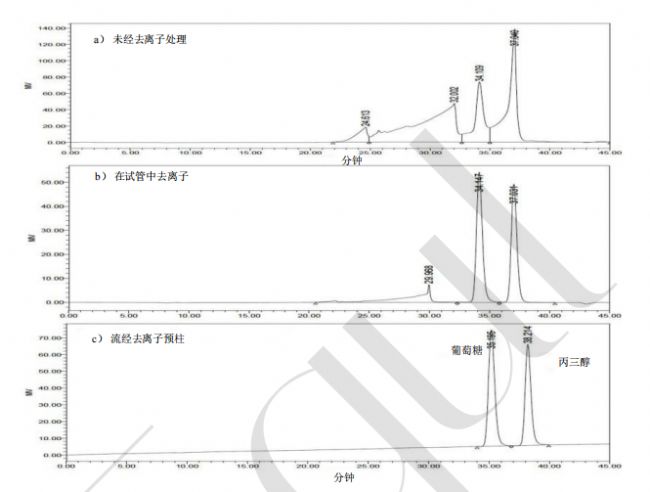
图 9:
(2) 测定 [IDF+SDFP]

式中 M1=样品质量 1(g);M2=样品质量 2(g);R1=M1的残渣质量 1(mg);R2=M2 的残渣质量 2(mg);PA=R1 的灰分质量(mg);PB=R2 的蛋白质质量(mg);B=测定的空白值[J(a)(1)](mg)。
注意:单独测定 IDF 和 SDFP 时也是使用上述公式。[参阅步骤 H(a)和 H(f)] 。
(b) SDFS(HPLC 法)
(1) 测定 D-葡萄糖响应因子
从两份重复样品的色谱图中获取 D-葡萄糖和内标物(丙三醇)的峰面积数值。D-葡萄糖与丙三醇的峰面积之比与 D-葡萄糖与丙三醇的质量之比的比率即“响应因子”。D-葡萄糖对丙三醇的响应因子约为 0.82。
响应因子(Rf)=

式中 PAGlu=D-葡萄糖峰面积;PAIS=内标物(丙三醇)峰面积;WtGlu=1 mL D-葡萄糖/丙三醇标准溶液中的 D-葡萄糖质量(10 mg);WtIS=1mL D-葡萄糖/丙三醇标准溶液中的内标物(丙三醇)质量(10 mg)。
(2) 测定 SDFS

式中,Rf=响应因子;WtIS=过滤前加入到样品中的 1 mL 丙三醇内标物溶液中的内标物质量(100 mg/mL,即 100 mg);PASDFS=SDFS 组分的峰面积;PAIS=丙三醇内标物峰面积;M=两份样品中,滤液用于色谱分析的其中一份样品的质量(M1或 M2),单位为 g。
(c)总膳食纤维
总膳食纤维(g/100g)=[IDF+SDFP](g/100g)+SDFS(g/100g)

注意:可以使用 Megazyme Mega-CalcTM来简化这些计算。可访问 Megazyme 网站(www.megazyme.com)下载 Megazyme Mega-CalcTM。

图 4:置于定制水浴槽中的 2mag Mixdrive 15®浸入式磁力搅拌器。可在 37℃下 170 rpm同时搅拌 15 个样品。

图 5:Grant OLS 200®振荡水浴槽,温度设定为37 ℃,图中为定制的适配 Fisherbrand®250 mL 玻璃瓶的聚丙烯支架。

图 6:布氏烧瓶、坩埚、橡胶套筒和真空歧管装置,用于过滤膳食纤维样品。图中还包括样品瓶和玻璃棒上的橡胶刮刀。

图 7:对采用 TSKgel® G2500PWXL 色谱柱进行色谱分析的样品进行在线去离子处理。14


图 9:
以下样品在 TSKgel® G2500PWXL 色谱柱上生成的色谱图
a) 未经去离子处理的 RINTDF 孵育缓冲液中的葡萄糖和丙三醇混合物;
b) 取与图(a)相同的 5 mL 样品,用 1.5 g Amberlite® FPA53 (OH- )和 1.5 gAmbersep® 200 (H+ )树脂进行去离子处理(如图 8 所示);
c) 安装去离子预柱后,样品“b”在相同的 TSK 柱上生成的色谱图 14。
RINTDF 检测程序的实验室间评估:
RINTDF 检测程序的实验室间评估:
本数据手册中说明的 RINTDF 方法是 AOAC 方法 2009.01 的更新,解决了在过去 8 年里,分析师们在使用 AOAC 方法 2009.01 时面临的诸多问题。本方法在美国官方分析化学家协会(AOAC International)和国际谷物科技协会(ICC)的组织下接受了实验室间评估 15。
共有 13 个实验室参与了本方法的实验室间评估,所有实验室都对 16 份检样(8份盲样,每份两个重复)中的大多数检样得出了有效检测数据。检样由不同含量的传统膳食纤维、抗性淀粉和不可消化的寡糖组成。8 对检样的膳食纤维含量范围为 6.90 至 60.37 g/100g。总膳食纤维含量为采用重量分析法测定的 IDF加 SDFP 的质量,和采用 HPLC 法测定的 SDFS 的质量之和。
由于参考文献 15 中所述的原因,在进行统计分析时,剔除了两个实验室的检测结果。剩下 11 个实验室的重复性标准偏差(Sr)范围为 0.27 至 0.76 g/100 g,再现性标准偏差(SR)范围为 0.54 至 3.99 g/100 g。相对重复性标准偏差(RSDr)范围为 1.22 至 6.52 %,相对再现性标准偏差(RSDR)范围为 2.14 至10.62 %(表 4)。这些统计值与采用其他膳食纤维检测方法对类似样品测得的结果一致 3。基于实验室间评估的结果,RINTDF 方法经 AOAC 批准为方法2017.16,并经 ICC 批准为标准草案 185。
表 4:食品总膳食纤维的实验室间研究结果(AOAC 方法 2017.16)。根据AOAC 统计数据格式进行统计评估。

样品:A&D=磷酸酯交联淀粉(Fibersym®);B&F=花豆(清洗冻干的罐头装);C&J=全谷麦片;E&H=含低聚果糖的脱脂饼干;G&N=燕麦麸;I&M=含葡聚糖和 RS2的脱脂饼干;K&O =黑麦薄脆饼干;L&P=全麦面包。
Sr:重复性;RSDr:相对重复性标准差;SR:再现性;RSDR:相对再现性标准差。
相关文章
更多 >

