α-淀粉酶检测试剂盒(CERALPHA METHOD)K-CERA使用说明书
2025-03-21 来源:本站 点击次数:1240α-淀粉酶检测试剂盒(CERALPHA METHOD)K-CERA
每个试剂盒100/200 次检测
引言
每个试剂盒100/200 次检测
AOAC方法2002.01
AACC方法22-02.01
ICC 标准 No. 303
引言
微生物α-淀粉酶在谷物制品中淀粉的改性以及谷物加工中应用广泛。 微生物α-淀粉酶在谷物制品中淀粉的改性以及谷物加工中应用广泛。谷物及其制品中内源性α-淀粉酶的水平对这些商品的工业利用具有显著影响。在面包制作中,α-淀粉酶的水平必须足够产生可被酵母吸收和利用的糖类,但又不能过高,否则会导致淀粉过度糊精化,从而引起面包内部粘稠和加工问题。在酿造行业,麦芽α-淀粉酶的水平是一个关键的质量参数。α-淀粉酶还作为青贮饲料添加剂使用,以帮助分解淀粉,从而为细菌生长提供可发酵的糖类。细菌、真菌和谷物α-淀粉酶都可以使用淀粉酶 HR 试剂进行测定,但测定条件(特别是 pH 值)需要根据每种特定酶进行调整。淀粉酶 HR 试剂专用于α-淀粉酶。该底物绝对抵抗外切酶(如β-淀粉酶、淀粉葡萄糖苷酶和α-葡萄糖苷酶)的水解。
原理:
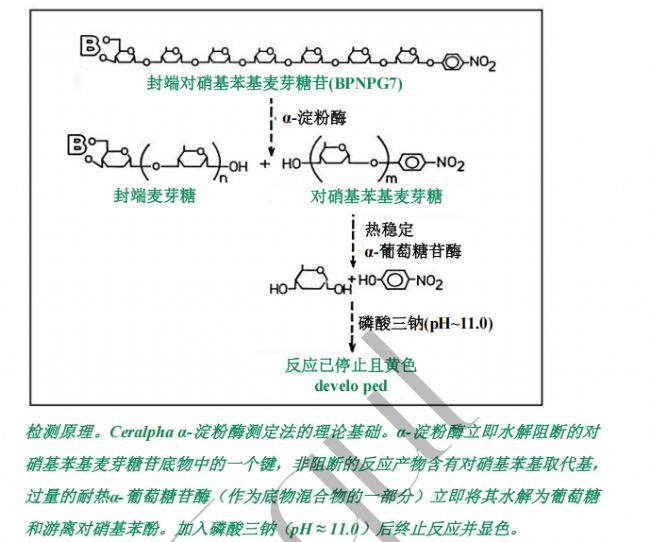
Ceralpha 法(使用淀粉酶 HR 试剂)测定α-淀粉酶的程序,采用“非还原端阻断的对硝基苯基麦芽庚糖苷”(BPNPG7)作为底物,在过量的耐热α-葡萄糖苷酶(由于“阻断基团”的存在,该酶对天然底物无作用)存在的情况下进行。内切作用的α-淀粉酶水解寡糖后,混合物中过量的α-葡萄糖苷酶会立即将对硝基苯基麦芽糖苷片段定量水解为葡萄糖和游离对硝基苯酚。测定格式见“测定原理”(第 17 页),测定的线性关系见图 1(第 11 页)。本质上,将谷物面粉提取
物或发酵液的样品在特定条件下与底物混合物孵育,然后通过加入弱碱溶液终止反应(并显色)。在 400 nm 处测量吸光度(以前的文献值为 410 nm,但实际吸收峰在 400 nm)(见第 12 页,图 4),该吸光度与样品中α-淀粉酶的水平直接相关。
淀粉酶 HR 试剂混合物可用于定量测定谷物、真菌和细菌α-淀粉酶。用耐热α-葡萄糖苷酶替代原始 Ceralpha 试剂混合物中的淀粉葡萄糖苷酶和酵母α-葡萄糖苷酶后,该测定法现在可以在更宽的 pH 范围(5.2 至 7.0)和高达 60°C 的温度下使用。使用这种新试剂,谷物α-淀粉酶的最佳活性 pH 为 5.2-5.4(见图 7,第16 页)。此外,在此 pH 范围内,使用淀粉酶 HR 试剂测得的谷物α-淀粉酶活性值与使用 Ceralpha 试剂(含有淀粉葡萄糖苷酶和α-葡萄糖苷酶)在 pH 5.2 测得的活性值基本相同。使用阻断对硝基苯基麦芽庚糖苷作为底物的试剂混合物无法区分真菌、谷物和细菌来源的α-淀粉酶。
准确性:
专一性:
准确性:
标准误差通常小于 5%。
试剂盒组成:
适用于进行 100/200 次检测的试剂盒由 Megazyme 提供,包括:
1. 完整的测定方法
2. 冻干的 BPNPG7 和耐热α-葡萄糖苷酶
3. 浓缩提取缓冲液
4. 浓缩终止试剂
5. 标准麦芽粉
专一性:
该方法对α-淀粉酶具有绝对特异性
表 1: Ceralpha 法测定小麦粉α-淀粉酶的重复性

表 1: Ceralpha 法测定小麦粉α-淀粉酶的重复性

a 分别在四天内对单一提取物进行重复分析。b基于对每个样本均值方差的汇总估计。单个观测值的标准差(用于比较同一天和不同天)=0.189
c.v.(%)=4.05。
c.v.(%)=4.05。
附带的底物:
阻断对硝基苯基麦芽庚糖苷(BPNPG7,54.5mg)
热稳定α-葡萄糖苷酶(pH 6.0 时为 125U),每瓶。
将一瓶的全部内容物溶于 10.0 mL 蒸馏水中, 等分为 2-3mL,冷冻储存。在 0-5°C 时,溶解的底物可稳定保存 7 天;冷冻状态下可稳定保存至少 12 个月。
附带的麦芽粉:
标准化α-淀粉酶活性的麦芽粉(如小瓶标签上所注明)
建议用户至少标准化一批自己的小麦粉或麦芽粉,作为二级质控样参考。
建议用户至少标准化一批自己的小麦粉或麦芽粉,作为二级质控样参考。
附带的溶液:
(1)浓缩提取缓冲液:
1 M 苹果酸(Buffer A)
1 M 氯化钠
40 mM 氯化钙
0.1%叠氮化钠
将全部内容物(50 mL)(以及可能出现的结晶沉淀)稀释至 1000 mL 蒸馏水中后使用。在 0-5°C 下可稳定保存 12 个月。pH 应为 5.4;如有必要请调整。
(2)浓缩终止试剂:
(20%[w/v]磷酸三钠 溶液,pH 约为 11)用蒸馏水将全部内容物(25mL)稀释至 500 mL,室温下可稳定保存 3 个月。
额外提取缓冲液的制备:
A. 缓冲液 A(用于谷物和真菌α-淀粉酶):
苹果酸(Sigma M0875; 1 M) 134.1g/L
氢氧化钠 70 g/L
氯化钠 58.4 g/L
二水氯化钙 (40mM) 5.9 g/L
叠氮化钠(Sigma S2002; 0.1 % ) 1.0 g/L
将苹果酸、氯化钠和氢氧化钠加入 800 mL 蒸馏水中,冷却至室温后加入氯化钙。通过逐滴加入氢氧化钠(4 M)或盐酸(4 M)将 pH 调整至 5.4,然后加入叠氮化钠。调整体积至 1 L。储存于室温。使用时,将 50 mL 浓缩缓冲液稀释至 1 L。
注意
在加入叠氮化钠之前,先将试剂溶解并调整 pH 至 5.4。将叠氮化钠加入酸性溶液中会产生有毒气体。苹果酸和富马酸粉末具有刺激性,应小心处理。
B. 缓冲液 B(用于芽孢杆菌属α-淀粉酶):
马来酸(Sigma M0375; 0.1 M) 23.2g/2L
氯化钠 11.6 g/2L
二水氯化钙(2mM) 0.6 g/2L
叠氮化钠(Sigma S2002;0.01%w/v) 0.2 g/2L
将马来酸和氯化钠加入 1600mL 蒸馏水中,用 4M(160g/L)氢氧化钠调节 pH 至6.5。加入氯化钙和叠氮化钠,调节体积至 2L。储存于室温。
直接使用此缓冲液,无需进一步稀释。
直接使用此缓冲液,无需进一步稀释。
一些细菌α-淀粉酶在稀释后不稳定。通常通过在缓冲液中加入 BSA(0.5mg/mL)
来解决这个问题。
额外终止试剂的制备:
将 10 克磷酸三钠(无水)溶解在 1L 蒸馏水中,调整 pH 至约 11.0。在室温下可稳定保存至少 3 个月。
设备(推荐):
1. 玻璃试管(12mL 和 20mL 容量 ) 。
2. 移液器,0.1 和/或 0.2mL (例如:Gilson Pipetman®)来分配酶提取液和底物。
3. 可调容积分配器:
- 0-10mL (用于提取缓冲液)。
- 0-5mL (用于终止试剂)。
4. 正位移移液器,例如 Eppendorf Multipette®
- 配备 5.0mL Combitip®(用于分配 0.5 mL 的浓缩酶溶液)。
- 配备 25 mL Combitip®(用于分配各种体积的稀释缓冲液)。
5. 托盘天平
6. 设定在 400 nm 的分光光度计。
7. 涡旋混合器(可选)。
8. 恒温水浴,设定在 40℃。
9. 秒表。
10. 台式离心机或 Whatman GF/A 玻璃纤维滤纸圆片(直径 9 cm)。
控制与预防措施:
1. α-淀粉酶是所有体液中含量较高的酶。因此,建议在处理和分配底物混合物时使用一次性手套。
2. 溶解 Ceralpha 底物混合物所用的水必须是高纯度的。如果没有新鲜蒸馏水,可将水煮沸后冷却至低于 30°C 再使用。洗瓶中的藻类生长会产生足够的α-淀粉酶,显著降低溶解在这种水中试剂的长期稳定性。
3. 冻干底物在室温下非常稳定,但溶解后在使用期间应于 0-5°C 保存,不使用时应低于-10°C 保存。如果一次测定的样本数量有限,建议将底物分成 2-3mL 的等分,冷冻保存。
4. 在 0-5°C 下保存时,空白吸光度值会在 5 天内从 0.03 增加到约 0.05。这不会影响底物的性能,但显然这些值必须在测定进行时同时确定。即使空白吸光度值高达 0.50,也不会影响测定的可靠性和准确性。
注意:
对于每批被分析的样品,通常只需一个反应空白。 要获得此空白值,将 3.0 mL终止试剂加入 0.2 mL 底物溶液中,然后加入 0.2 mL 酶制剂。
5. 所用的分光光度计应使用对硝基苯酚标准液在 1%磷酸三钠中进行标准化(εmM = 18.1)。对硝基苯酚溶液(10 mM)可从 Sigma Chemical Company获得(产品编号 N7660)。将该溶液稀释 200 倍后,在 1%磷酸三钠中于400 nm 处的吸光度为 0.905。
6. 测定时应使用附带的麦芽粉标准样。该面粉的酶活性显示在附带的标签上。
7. 小麦粉的提取时间应严格控制在 15-20 分钟。对于麦芽粉样品,最佳提取时间也是 15-20 分钟。
有用的提示:
1. 如果某个特殊测定的吸光度值大于 1.20,酶提取液应用适当的缓冲液稀释并重新测定。
液体制剂:
分析程序:
2. 如果将所有试剂的体积减半,并使用半微量分光光度计比色皿,则试剂盒可
进行的测定次数可增加一倍。
酶提取:
A. 小麦和大麦面粉:
1. 将小麦、大麦或其他谷物(约 10-50 g 样品)磨碎至通过 0.5 mm 筛(例如使
用 Fritsch 离心磨) 。
2. 准确称取 3.0 g 面粉,放入 50 mL 容量的烧瓶中。
3. 向每个烧瓶中加入 20.0 mL 提取缓冲液(pH 5.4),并剧烈搅拌烧瓶内容物。
4. 在 40°C 下提取酶 15-20 分钟,期间偶尔搅拌。
5. 通过 Whatman GF/A 玻璃纤维滤纸过滤部分溶液,或以 1,000 g 离心 10 分钟。在 2 小时内测定酶活性。
B. 麦芽粉:
1. 将麦芽(20 g 样品)磨碎至通过 0.5 mm 筛。
2. 准确称取 0.5 g 麦芽粉,放入 100 mL 容量瓶中。
3. 向容量瓶中加入 1%氯化钠、0.02%氯化钙和 0.02%叠氮化钠的溶液,并调整体积。
4. 在室温下提取酶 15-20 分钟,期间偶尔搅拌。
5. 通过 Whatman GF/A 玻璃纤维滤纸过滤部分溶液,或以 1,000 g 离心 10 分钟。
6. 用提取缓冲液稀释 0.5 mL 滤液至 9.5 mL。在 2 小时内测定酶活性(见第 6页 A 部分第 5 点)。
C. 微生物制剂:
液体制剂:
1. 使用正位移分配器,将 1 mL 液体酶制剂加入 49 mL 缓冲液 A 或 B(pH 5.4或 6.5)中,充分混合。这称为原始提取液。
2. 取 1.0 mL 原始提取液,加入 9.0 mL 适当的缓冲液(A 或 B)中,充分混合。重复此步骤,直至获得适合测定的稀释度。例如,对于工业酶制剂(如爱尔兰 Kerry Ingredients 的细菌α-淀粉酶),原始提取液需稀释约 4,000 倍。
粉末制剂:
1. 将 1g 酶粉制剂加入 50mL 的缓冲液 A 或 B(pH 5.4 或 6.5)中,轻轻搅拌约 15分钟,直至样品完全分散或溶解。2. 通过离心(1000 g,10 分钟)或 WhatmanNo.1(直径 9 cm)滤纸过滤澄清该溶液(即原始提取液)。3. 取 1.0 mL 该溶液,加入 9.0 mL 适当的提取/稀释缓冲液中,充分混合。重复此步骤,直至获得适合测定的稀释度。
分析程序:
A. 小麦和大麦面粉:
1. 将 0.2mL 的淀粉酶 HR 试剂溶液(未缓冲)分配到试管中,并将试管及内容物在 40°C 下预孵育 5 分钟。
2. 将谷物提取液在 40°C 下预孵育 5 分钟。
3. 向每个含有 0.2 mL 淀粉酶 HR 试剂溶液的试管中,直接在试管底部加入 0.2mL 预平衡的小麦或大麦提取液。在 40°C 下孵育 20 分钟(从加入时间开始计时)。
4. 在 20 分钟孵育期结束后,准确加入 3.0 mL 终止试剂,并剧烈搅拌试管内容
物。
5. 在 400 nm 处读取溶液和反应空白的吸光度,以蒸馏水为对照。
B. 麦芽和微生物制剂:
1. 将 0.2mL 的淀粉酶 HR 试剂溶液(未缓冲)分配到试管中,并将试管及内容物在 40°C 下预孵育 5 分钟。
2. 将缓冲后的麦芽或微生物制剂提取液在 40°C 下预孵育 5 分钟。
3. 向每个含有 0.2 mL 淀粉酶 HR 试剂溶液的试管中,直接在试管底部加入 0.2mL 预平衡(并适当稀释)的微生物酶或麦芽提取液。在 40°C 下孵育 10 分钟(从加入时间开始计时)。
4. 在 10 分钟孵育期结束后,准确加入 3.0 mL 终止试剂,并剧烈搅拌试管内容物。
5. 在 400 nm 处读取溶液和反应空白的吸光度,以蒸馏水为对照。
酶活计算:
一个活性单位定义为在过量耐热α-葡萄糖苷酶存在的情况下,每分钟从BPNPG7 释放一微摩尔对硝基苯酚所需的酶量,称为 Ceralpha 单位(CU)。单位/克面粉:

其中:
ΔA400
=反应吸光度−空白吸光度
孵育时间
=麦芽和微生物制剂提取液:10 分钟
=小麦和大麦提取液:20 分钟
比色皿中的总体积 =3.4 mL
测定的样品体积
=0.2 mL
对硝基苯酚在 1%磷酸三钠中的摩尔吸光系数εmM(在 400 nm 处)= 18.1
提取体积=
小麦和大麦:每 3 克 20 mL
麦芽:每 0.5 克 100 mL
微生物制剂:每 1 克或 1 mL 50 mL
稀释倍数
=原始提取液的稀释倍数(麦芽提取液为 20 倍)
因此:
A. 对于小麦和大麦:
单位(CU)/克面粉:



单位(CU)/克面粉:

B. 对于麦芽:
单位(CU)/克磨碎麦芽:

C. 对于微生物制剂:
单位(CU)/ mL 或 g 原始制剂:

其中:
ΔA400
=反应吸光度−空白吸光度
孵育时间=10 分钟
比色皿中的总体积 =3.4 mL
测定的样品体积=0.2 mL
对硝基苯酚在 1%磷酸三钠中的摩尔吸光系数εmM(在 400 nm 处)= 18.1
提取体积=每 1 克 50 mL (或 49 mL 加 1 mL 浓缩酶液)
稀释倍数=原始提取液的稀释倍数
附录:
A. Ceralpha 测定法与酶浓度和孵育时间的线性关系


图 1. Ceralpha 测定法与麦芽α-淀粉酶在苹果酸钠缓冲液(pH 5.4)中的线性关系。测定使用了四种浓度的酶(1 倍、2 倍、3 倍和 4 倍)。反应通过加入磷酸三钠(3.0 mL,1% w/v)在不同时间终止。
B.耐热α-葡萄糖苷酶浓度对测定的α-淀粉酶值的影响
从图 2 的结果可以看出,底物溶液中饱和反应所需的α-葡萄糖苷酶浓度为 12U/mL。

图 2. 耐热α-葡萄糖苷酶在底物试剂溶液中的浓度对测定吸光度值的影响。

将试剂的等分试样在 60°C 下孵育 0-20 分钟,冷却至室温后用于在 40°C 下测定真菌α-淀粉酶。

从图 2 的结果可以看出,底物溶液中饱和反应所需的α-葡萄糖苷酶浓度为 12U/mL。

图 2. 耐热α-葡萄糖苷酶在底物试剂溶液中的浓度对测定吸光度值的影响。
C. 试剂混合物在 60℃下的稳定性。
通过将试剂溶液的等分试样在 60°C 下孵育 0-20 分钟来确定试剂溶液的稳定性。这些溶液随后用于测定真菌α-淀粉酶的活性(在 40°C 下进行)。从图 3 的数据可以看出,该试剂在 60°C 下非常稳定。在 20 分钟的孵育期内,空白吸光度值增加了不到 0.01 吸光度单位,测定的活性下降不到 3%(与未预孵育的试剂相比)。

图 3. 淀粉酶 HR 测定试剂在 60°C 下的温度稳定性。
将试剂的等分试样在 60°C 下孵育 0-20 分钟,冷却至室温后用于在 40°C 下测定真菌α-淀粉酶。

D. 以淀粉为底物,Ceralpha 单位(CU)与国际单位(IU)的换算
使用淀粉酶 HR 试剂和 ACS 可溶性淀粉(1% w/v;使用 Nelson-Somogyi 还原糖法测定;国际单位)测定了纯枯草芽孢杆菌、黑曲霉和大麦麦芽α-淀粉酶的活性,换算因子如下:
黑曲霉(两种测定均在 pH 5.4 下进行)
以淀粉为底物,IU=0.94×CU
枯草芽孢杆菌(两种测定均在 pH6.5 下进行)
以淀粉为底物,IU=4.6×CU
大麦麦芽(两种测定均在 pH 5.4 下进行)
以淀粉为底物,IU=4.1×CU
一个酶活国际单位 (IU) 的定义是:在温度和 pH 值确定的条件下 ,每分钟
释放一微摩尔葡萄糖还原糖当量所需的酶量。
E. Ceralpha 法和 Farrand 法测定小麦和真菌α-淀粉酶的比较。
Farrand 法使用淀粉的β-极限糊精作为底物,通过测量淀粉/碘络合物在底物降解时颜色的减少来测定。测定在过量的β-淀粉酶存在下进行,对于谷物样品,β-淀粉酶来自面粉提取液;对于真菌样品,需要添加纯β-淀粉酶。Farrand 法曾在英国 广泛使 用, 并使用 Rank Hovis 公司 提供的 β- 极限 糊精。 [Megazyme International 现提供一种纯化的β-极限糊精(已去除麦芽糖)。] 在标准 Farrand法中,提取液未缓冲,面粉提取液的 pH 约为 5.8。
在 Campden-Chorleywood 食品研究协会协调的 Farrand 法和 Ceralpha 法的实验室间比较中,小麦面粉α-淀粉酶的 Farrand 单位与 Ceralpha 单位的相关性为:
Farrand 单位 = Ceralpha 单位 × 57 - 1.9
一个国际单位(IU)的酶活定义为在特定的温度和 pH 条件下,每分钟释放一微摩尔葡萄糖还原糖当量所需的酶量。
McCleary 和 Sheehan(McCleary and Sheehan,1987)曾报告过类似的相关性:
Farrand 单位 = Ceralpha 单位 × 57.1
Farrand 单位 = Ceralpha 单位 × 57.1
对于真菌样品,McCleary 等人得到的回归方程为:
Farrand 单位 = Ceralpha 单位×69
在添加了真菌α-淀粉酶的小麦面粉中测定α-淀粉酶时,由于两种组分混合的问题(其中一种组分的酶含量很低,另一种组分的酶含量比第一种组分高数千倍),可能会出现误差。为了尽量减少可能由于这两种组分混合不完全而导致的误差,应进行双份样品测定,并提取较大样品(约 6 g/40 mL)。
F. Ceralpha 法(CU)、ASBC 法(DU)与 AACC 法 22-01(SKB 单位)
测定α-淀粉酶的比较
AACC 法 22-01(SKB 单位)使用一种由 AACC/ASBC 提供的“特殊”林特纳淀粉制备的β-极限糊精。该方法通过测量α-淀粉酶在 30°C 下与β-极限糊精孵育时达到特定碘色的时间来测定。
ASBC/EBC/国际法(糊精化单位,DU)使用与 AACC 法 22-01 相同的底物和相同的酶浓度,活性单位的计算方式也相同。然而,由于该测定在 20°C 下进行,因此对于特定麦芽样品,DU 值大约是同一麦芽样品 SKB 值的一半。AACC 方法 22-01(SKB 单位)和麦芽粉 Ceralpha 单位(CU)之间的关系如图 5 所示。α-淀粉酶(DU)的 ASBC(国际方法)和 Ceralpha 方法(CU)之间的关系如图 6 所示。



图 5. Ceralpha 法和 AACC 法 22-01(SKB)测定麦芽粉中α-淀粉酶的相关性用两种方法对 7 份麦芽样品进行重复分析。

图 6 Ceralpha 法和 ASBC(国际法)测定麦芽粉中α-淀粉酶的相关性。用两种方法对 7 份麦芽样品进行重复分析。
麦芽、真菌和细菌 a-淀粉酶的 SKB 单位与 Ceralpha 单位的换算系数如下:
麦芽α-淀粉酶:
SKB 单位=0.42×Ceralpha 单位(CU)-0.34。
(SKB 在 pH 4.7 下进行;Ceralpha 在 pH 5.4 下进行)。
真菌α-淀粉酶:
SKB 单位 = 0.60 x Cera lpha 单位(CU ) 。
(SKB 在 pH 5.4 下进行;Ceralpha 在 pH 5.4 下进行)。
细菌α-淀粉酶:
SKB 单位 = 1.8 x Ceralpha 单位(CU ) 。
(SKB 在 pH 6.5 下进行;Ceralpha p 在 pH 6.5 进行。
G. 谷物、真菌和细菌α-淀粉酶 在不同 pH 值下的活力曲线
使用 Ceralpha 法和淀粉酶 HR 试剂测定了小麦麦芽、大麦麦芽、真菌(黑曲霉)和细菌(枯草芽孢杆菌)α-淀粉酶的 pH 活性曲线。对于谷物和真菌α-淀粉酶,使用苹果酸和富马酸缓冲液(100 mM,pH 5.0-6.4)制备 pH 曲线;对于细菌α-淀粉酶,使用富马酸和 Bis-Tris 丙烷缓冲液(pH 5.6-9.0)。所有缓冲液均含有10 mM 氯化钙。纯化的小麦麦芽和真菌α-淀粉酶的曲线如图 7 所示。大麦麦芽α-淀粉酶的曲线与小麦麦芽相同。枯草芽孢杆菌α-淀粉酶的 pH 活性曲线如图 8所示。

真菌α-淀粉酶使用淀粉酶 HR 试剂和 Ceralpha 试剂(含有淀粉葡萄糖苷酶和酵母α-葡萄糖苷酶)进行测定,两条曲线相同。
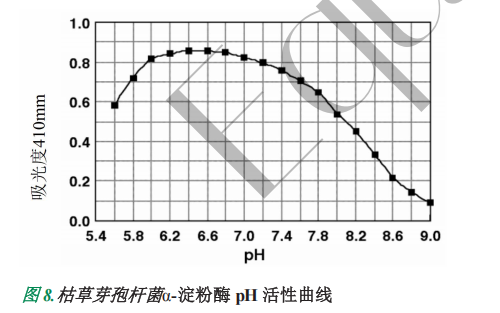
使用 Ceralpha 法和淀粉酶 HR 试剂测定了小麦麦芽、大麦麦芽、真菌(黑曲霉)和细菌(枯草芽孢杆菌)α-淀粉酶的 pH 活性曲线。对于谷物和真菌α-淀粉酶,使用苹果酸和富马酸缓冲液(100 mM,pH 5.0-6.4)制备 pH 曲线;对于细菌α-淀粉酶,使用富马酸和 Bis-Tris 丙烷缓冲液(pH 5.6-9.0)。所有缓冲液均含有10 mM 氯化钙。纯化的小麦麦芽和真菌α-淀粉酶的曲线如图 7 所示。大麦麦芽α-淀粉酶的曲线与小麦麦芽相同。枯草芽孢杆菌α-淀粉酶的 pH 活性曲线如图 8所示。

真菌α-淀粉酶使用淀粉酶 HR 试剂和 Ceralpha 试剂(含有淀粉葡萄糖苷酶和酵母α-葡萄糖苷酶)进行测定,两条曲线相同。


相关文章
更多 >

