脐带间充质干细胞衍生小细胞外囊泡减轻辐射诱导的心脏类器官损伤研究
2025-04-08 来源:本站 点击次数:293
研究背景:
通常心脏被认为是耐辐射器官。然而,胸部恶性肿瘤放疗出现的心脏副作用使放射性心脏损伤受到越来越多的关注。RIHD会对心脏结构、传导系统和循环系统造成不可逆损伤。目前,尽管他汀类药物(羟甲基戊二酰辅酶A还原酶抑制剂)、血管紧张素转换酶抑制剂(ACEIs)和抗氧化剂在减轻辐射诱导的心脏损伤方面有效,但手术干预仍不可避免。因此,迫切需要开发针对 RIHD 的有效治疗方法。
小细胞外囊泡(sEVs)最初被认为是源自血小板和红细胞的细胞残余物,但其在组织修复、再生、信号传导和诱导细胞分化方面的潜力已引起研究人员的日益关注。脐带间充质干细胞来源的sEVs(UCMSCs-sEVs)可减轻纤维化、抑制炎症反应、抑制氧化应激损伤、促进组织修复并减少细胞凋亡。这些综合优势是单一药物治疗无法比拟的。UCMSCs-sEVs已在膜增生性肾小球肾炎、肝缺血-再灌注损伤和骨关节炎相关软骨损伤等多种疾病中显示出治疗效果且无不良反应。值得注意的是,目前关于sEVs用于治疗RIHD的研究尚属匮乏。
基于此,军事医学研究院王华教授团队与檀英霞教授团队近期在Stem Cell Research & Therapy杂志上发表"Small extracellular vesicles derived from umbilical cord mesenchymal stem cells alleviate radiation-induced cardiac organoid injury"相关文章。

研究方法:
本研究通过使用高分辨荧光标测技术(Optical Mapping)对不同组类器官钙信号活动的速度、离散度、振幅、频率及复极时间等指标进行检测,探究UCMSCs-sEVs对辐射损伤心脏类器官的治疗作用。
研究结果:
1. 从人诱导多能干细胞(hiPSCs)构建心脏类器官
本研究参照Hofbauer等人的实验方案,成功在体外构建心脏类器官。通过96孔U型板培养hiPSC球体,在分化30天的免疫荧光分析表明,球体内核含cTnT/MYL7阳性心肌细胞并表达心室标记IRX4,外围包膜含CDH5/PECAM1阳性心内膜细胞及波形蛋白阳性间充质细胞,结构类似早期胚胎心室心内膜。研究证实,通过精准信号调控构建的心脏类器官兼具功能与结构特征,为心脏发育及疾病研究提供有效模型。

图1 心脏类器官的制备
2. UCMSCs-sEVs的提取与鉴定
通过差速离心法从UCMSCs的上清液中提取小细胞外囊泡(sEVs)。随后利用纳米颗粒跟踪分析(NTA)检测UCMSCs-sEVs的粒径分布和浓度,结果显示其平均直径约为138nm,浓度为5.5×10¹¹颗粒 / 毫升。透射电子显微镜(TEM)图像显示,UCMSCs-sEVs呈圆形或椭圆形,具有双膜结构,直径约100nm。蛋白质印迹法(WB)结果表明,sEVs表达四次跨膜蛋白CD63、CD9及肿瘤易感基因101,同时也表达其来源细胞UCMSCs的标记物CD90。

图2 UCMSCs-sEVs的鉴定及治疗浓度优化

4. UCMSCs-sEVs治疗减轻了辐射损伤的心脏类器官超微结构损伤
线粒体为心脏供能,心肌纤维是心脏自主活动的功能基础,二者是心肌细胞关键结构。通过TEM观察辐射及UCMSCs-sEVs治疗后心脏类器官超微结构,发现辐射导致肌纤维排列紊乱、线粒体显著自噬及空泡化(内膜褶皱减少),肌原纤维长度异常增加。UCMSCs-sEVs治疗组中,以上现象被抑制。研究表明,UCMSCs-sEVs通过修复线粒体和心肌纤维超微结构损伤,减轻辐射对心脏类器官的结构性破坏,为其治疗放射性心脏损伤提供细胞学依据。

图4 辐射和UCMSCs-sEVs治疗后心脏类器官的超微结构特征


图6 UCMSCs-sEVs恢复了辐射损伤的心脏类器官的正常钙瞬变

图8 UCMSCs-sEVs在辐射诱导的心脏类器官损伤中的潜在作用机制
通常心脏被认为是耐辐射器官。然而,胸部恶性肿瘤放疗出现的心脏副作用使放射性心脏损伤受到越来越多的关注。RIHD会对心脏结构、传导系统和循环系统造成不可逆损伤。目前,尽管他汀类药物(羟甲基戊二酰辅酶A还原酶抑制剂)、血管紧张素转换酶抑制剂(ACEIs)和抗氧化剂在减轻辐射诱导的心脏损伤方面有效,但手术干预仍不可避免。因此,迫切需要开发针对 RIHD 的有效治疗方法。
小细胞外囊泡(sEVs)最初被认为是源自血小板和红细胞的细胞残余物,但其在组织修复、再生、信号传导和诱导细胞分化方面的潜力已引起研究人员的日益关注。脐带间充质干细胞来源的sEVs(UCMSCs-sEVs)可减轻纤维化、抑制炎症反应、抑制氧化应激损伤、促进组织修复并减少细胞凋亡。这些综合优势是单一药物治疗无法比拟的。UCMSCs-sEVs已在膜增生性肾小球肾炎、肝缺血-再灌注损伤和骨关节炎相关软骨损伤等多种疾病中显示出治疗效果且无不良反应。值得注意的是,目前关于sEVs用于治疗RIHD的研究尚属匮乏。
基于此,军事医学研究院王华教授团队与檀英霞教授团队近期在Stem Cell Research & Therapy杂志上发表"Small extracellular vesicles derived from umbilical cord mesenchymal stem cells alleviate radiation-induced cardiac organoid injury"相关文章。

研究方法:
本研究通过使用高分辨荧光标测技术(Optical Mapping)对不同组类器官钙信号活动的速度、离散度、振幅、频率及复极时间等指标进行检测,探究UCMSCs-sEVs对辐射损伤心脏类器官的治疗作用。
研究结果:
1. 从人诱导多能干细胞(hiPSCs)构建心脏类器官
本研究参照Hofbauer等人的实验方案,成功在体外构建心脏类器官。通过96孔U型板培养hiPSC球体,在分化30天的免疫荧光分析表明,球体内核含cTnT/MYL7阳性心肌细胞并表达心室标记IRX4,外围包膜含CDH5/PECAM1阳性心内膜细胞及波形蛋白阳性间充质细胞,结构类似早期胚胎心室心内膜。研究证实,通过精准信号调控构建的心脏类器官兼具功能与结构特征,为心脏发育及疾病研究提供有效模型。

图1 心脏类器官的制备
2. UCMSCs-sEVs的提取与鉴定
通过差速离心法从UCMSCs的上清液中提取小细胞外囊泡(sEVs)。随后利用纳米颗粒跟踪分析(NTA)检测UCMSCs-sEVs的粒径分布和浓度,结果显示其平均直径约为138nm,浓度为5.5×10¹¹颗粒 / 毫升。透射电子显微镜(TEM)图像显示,UCMSCs-sEVs呈圆形或椭圆形,具有双膜结构,直径约100nm。蛋白质印迹法(WB)结果表明,sEVs表达四次跨膜蛋白CD63、CD9及肿瘤易感基因101,同时也表达其来源细胞UCMSCs的标记物CD90。

图2 UCMSCs-sEVs的鉴定及治疗浓度优化
3. UCMSCs-sEVs提高了辐射损伤后心脏类器官的能量代谢能力
活/死染色显示,20Gy X射线辐射后48小时心脏类器官损伤最显著,优化确定UCMSCs-sEVs治疗辐射损伤的最佳浓度为2×10¹⁰颗粒 / 毫升。Seahorse分析表明,辐射导致心脏类器官线粒体功能下降,而UCMSCs-sEVs干预可显著提升其最大呼吸能力、基础呼吸和备用呼吸能力,增强 ATP生成,恢复质子漏并调节呼吸耦合效率。此外,辐射后心脏类器官糖酵解水平及储备能力降低,UCMSCs-sEVs治疗逆转了细胞外酸化率(ECAR)异常。综上,UCMSCs-sEVs通过改善线粒体呼吸和糖酵解功能,减轻辐射对心脏类器官的能量代谢损伤,为放射性心脏损伤治疗提供实验依据。
活/死染色显示,20Gy X射线辐射后48小时心脏类器官损伤最显著,优化确定UCMSCs-sEVs治疗辐射损伤的最佳浓度为2×10¹⁰颗粒 / 毫升。Seahorse分析表明,辐射导致心脏类器官线粒体功能下降,而UCMSCs-sEVs干预可显著提升其最大呼吸能力、基础呼吸和备用呼吸能力,增强 ATP生成,恢复质子漏并调节呼吸耦合效率。此外,辐射后心脏类器官糖酵解水平及储备能力降低,UCMSCs-sEVs治疗逆转了细胞外酸化率(ECAR)异常。综上,UCMSCs-sEVs通过改善线粒体呼吸和糖酵解功能,减轻辐射对心脏类器官的能量代谢损伤,为放射性心脏损伤治疗提供实验依据。

图3 UCMSCs-sEVs提高了辐射损伤的心脏类器官的能量代谢能力
4. UCMSCs-sEVs治疗减轻了辐射损伤的心脏类器官超微结构损伤
线粒体为心脏供能,心肌纤维是心脏自主活动的功能基础,二者是心肌细胞关键结构。通过TEM观察辐射及UCMSCs-sEVs治疗后心脏类器官超微结构,发现辐射导致肌纤维排列紊乱、线粒体显著自噬及空泡化(内膜褶皱减少),肌原纤维长度异常增加。UCMSCs-sEVs治疗组中,以上现象被抑制。研究表明,UCMSCs-sEVs通过修复线粒体和心肌纤维超微结构损伤,减轻辐射对心脏类器官的结构性破坏,为其治疗放射性心脏损伤提供细胞学依据。

图4 辐射和UCMSCs-sEVs治疗后心脏类器官的超微结构特征
5. UCMSCs-sEVs可保护心脏类器官免受辐射引起的氧化应激和线粒体损伤
采用TMRM染色评估辐射及不同时间点UCMSCs-sEVs治疗后心脏类器官的线粒体膜电位(ΔΨm)。结果显示,20Gy X射线辐射后24小时和48小时,ΔΨm(红色荧光强度)下降,经UCMSCs-sEVs治疗后恢复。通过MitoSOX染色结合共聚焦显微镜观察线粒体活性氧(ROS),辐射后12小时和24小时,ROS表达显著升高,UCMSCs-sEVs治疗后ROS表达被抑制。但辐射后48小时未观察到与12小时、24小时相同的ROS升高趋势,推测辐射对ROS的影响可能是快速且短暂的,在辐射后期效应减弱,但辐射对ΔΨm的损伤持续存在。
采用TMRM染色评估辐射及不同时间点UCMSCs-sEVs治疗后心脏类器官的线粒体膜电位(ΔΨm)。结果显示,20Gy X射线辐射后24小时和48小时,ΔΨm(红色荧光强度)下降,经UCMSCs-sEVs治疗后恢复。通过MitoSOX染色结合共聚焦显微镜观察线粒体活性氧(ROS),辐射后12小时和24小时,ROS表达显著升高,UCMSCs-sEVs治疗后ROS表达被抑制。但辐射后48小时未观察到与12小时、24小时相同的ROS升高趋势,推测辐射对ROS的影响可能是快速且短暂的,在辐射后期效应减弱,但辐射对ΔΨm的损伤持续存在。

图5 UCMSCs-sEVs治疗改善了辐射损伤的心脏类器官的线粒体膜电位,并降低了氧化应激
6. UCMSCs-sEVs恢复了辐射损伤心脏类器官的正常钙瞬变
钙离子内流是心肌兴奋-收缩耦联的特征。心脏类器官具有类似窦房结的起搏位点,驱动整个三维球体的收缩。X射线辐射后,电子显微镜下观察到肌原纤维变化,促使我们检测心脏类器官的钙信号。通过高分辨荧光标测技术评估心脏类器官的钙瞬变(calcium transients)变化,研究钙信号活动的速度、离散度、振幅、频率及复极时间等指标的改变。结果表明,UCMSCs-sEVs治疗逆转了辐射损伤导致的钙处理异常事件。
钙离子内流是心肌兴奋-收缩耦联的特征。心脏类器官具有类似窦房结的起搏位点,驱动整个三维球体的收缩。X射线辐射后,电子显微镜下观察到肌原纤维变化,促使我们检测心脏类器官的钙信号。通过高分辨荧光标测技术评估心脏类器官的钙瞬变(calcium transients)变化,研究钙信号活动的速度、离散度、振幅、频率及复极时间等指标的改变。结果表明,UCMSCs-sEVs治疗逆转了辐射损伤导致的钙处理异常事件。

图6 UCMSCs-sEVs恢复了辐射损伤的心脏类器官的正常钙瞬变
7. UCMSCs-sEVs减轻了辐射诱导的小鼠心脏损伤
本研究构建了放射性心脏损伤的小鼠模型,研究发现辐射后第14天,小鼠多种心肌酶浓度升高(LDH1 持续升高),UCMSCs-sEVs治疗显著改善心肌酶谱。心功能检测显示,辐射导致左心室射血分数(LVEF)和缩短分数(LVFS)下降,治疗后明显回升。超微结构观察表明,该治疗减轻了辐射引起的线粒体嵴减少、肌原纤维排列紊乱及胶原沉积。RT-qPCR结果显示,辐射诱导促炎因子(IL-1α/β、IL-6、TNF-α)和纤维化因子(TGF-β、α-SMA、I/III 型胶原)表达升高,抗炎因子IL-10降低,而UCMSCs-sEVs治疗逆转了上述异常。心脏类器官中炎症和纤维化相关基因的表达与在小鼠心脏中观察到的结果一致。
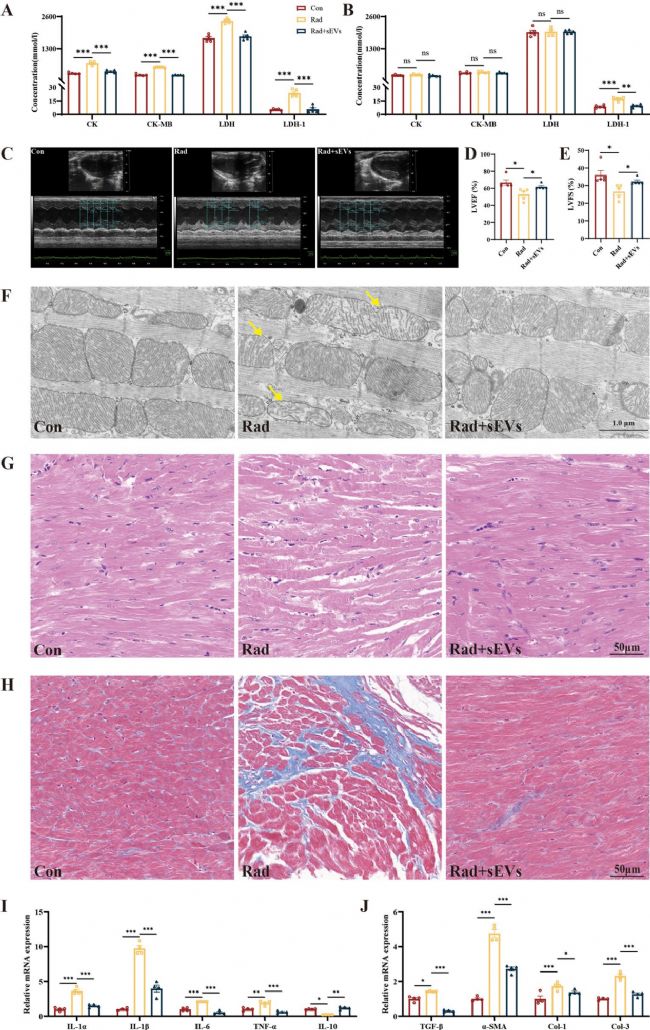
图7 UCMSCs-sEVs对辐射诱导的小鼠心脏损伤的治疗作用
8. 与氧化磷酸化通路和P53信号通路相互作用的铜代谢异常可能是辐射诱导的心脏类器官损伤的关键
为探究辐射损伤及UCMSCs-sEVs治疗机制,对心脏类器官进行RNA-seq分析,发现835个差异表达基因(DEGs),富集到p53信号通路。UCMSCs-sEVs通过调控p53信号、修复氧化磷酸化及相关通路,逆转辐射诱导的基因表达异常,为放射性心脏损伤治疗提供分子机制证据。
为探究辐射损伤及UCMSCs-sEVs治疗机制,对心脏类器官进行RNA-seq分析,发现835个差异表达基因(DEGs),富集到p53信号通路。UCMSCs-sEVs通过调控p53信号、修复氧化磷酸化及相关通路,逆转辐射诱导的基因表达异常,为放射性心脏损伤治疗提供分子机制证据。

图8 UCMSCs-sEVs在辐射诱导的心脏类器官损伤中的潜在作用机制
结论:
本研究利用UCMSCs-sEVs治疗放射性心脏类器官损伤(RICoI),对线粒体结构和功能以及电信号传导的观察,发现其对RICoI具有显著治疗效果。这种治疗作用可能归因于p53信号通路、氧化磷酸化信号通路及铜离子积累的协同效应。该研究首次报道辐射可诱导心脏类器官发生铜死亡(cuproptosis),并证实UCMSCs-sEVs能够缓解RICoI及放射性缺血性心脏病(RIHD)。这些发现不仅有助于理解放射性心脏损伤,也为RIHD的治疗提供了新策略。
本研究利用UCMSCs-sEVs治疗放射性心脏类器官损伤(RICoI),对线粒体结构和功能以及电信号传导的观察,发现其对RICoI具有显著治疗效果。这种治疗作用可能归因于p53信号通路、氧化磷酸化信号通路及铜离子积累的协同效应。该研究首次报道辐射可诱导心脏类器官发生铜死亡(cuproptosis),并证实UCMSCs-sEVs能够缓解RICoI及放射性缺血性心脏病(RIHD)。这些发现不仅有助于理解放射性心脏损伤,也为RIHD的治疗提供了新策略。
相关文章
更多 >

