空间多组学助力预测非小细胞肺癌的免疫治疗反应
2025-11-18 来源:本站 点击次数:94题目:Spatial signatures for predicting immunotherapy outcomes using multi-omics in non-small cell lung cancer
期刊:Nature Genetics
IF:29
DOI:10.1038/s41588-025-02351-7
01 研究背景
非小细胞肺癌(NSCLC)是肺癌的主要类型,晚期患者通常预后较差。免疫治疗已成为晚期NSCLC的标准一线治疗方案,通过抑制PD-1/PD-L1通路激活患者免疫系统攻击肿瘤细胞。然而,在临床实践中,只有约20-40%的患者能从中获得长期益处。即使肿瘤细胞表面PD-L1蛋白表达水平较高,也有相当数量的患者会出现初始耐药,表明仅用单一分子标志物来预测治疗效果是不足够的。
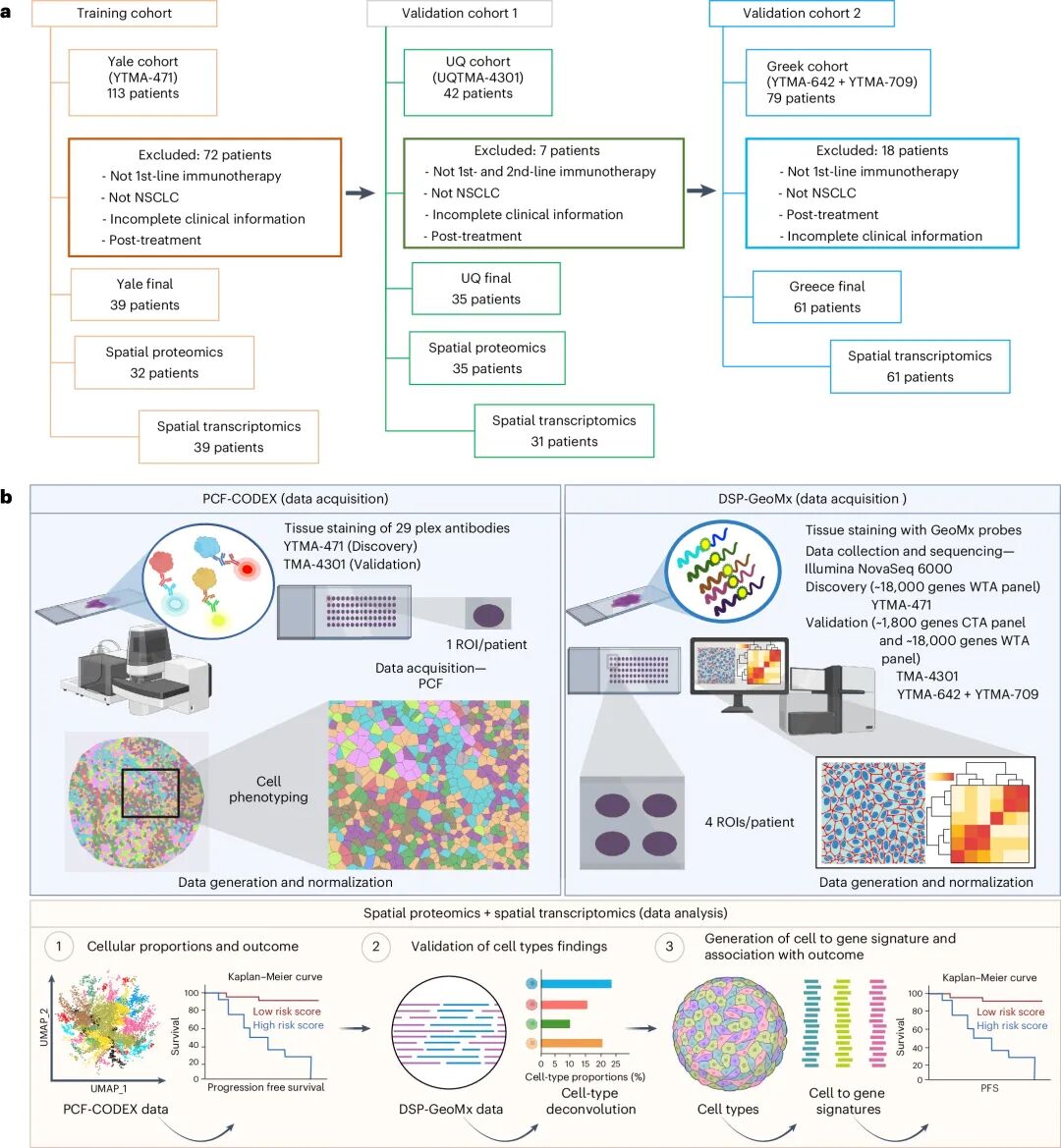
为了应对这一问题,研究团队利用空间蛋白组平台(PCF-CODEX)结合空间转录组平台(GeoMx DSP),对234名接受PD-1/PD-L1免疫治疗的晚期NSCLC患者进行了分析。通过空间多组学方法探讨免疫治疗的效果,以及肿瘤免疫微环境(TIME)中细胞和基因的空间分布关系。该研究建立了从空间细胞类型到基因特征的预测模型,并在独立队列中证实其可以有效预测患者的无进展生存期(PFS)。
02 实验设计与技术手段
本研究纳入了234例晚期NSCLC患者的样本,患者均接受了PD-1/PD-L1免疫治疗。
67例患者样本采用PCF-CODEX空间蛋白组平台进行多重抗体染色,解析多种主要细胞类型的空间分布和相互作用,以及肿瘤微环境的空间组织模式;
131例患者样本采用GeoMx DSP Whole Transcriptome Atlas空间转录组学平台进行空间转录组测序,利用荧光标记定义细胞,每个患者选取1-4个AOI,从而实现对肿瘤区与基质区的的特异性捕获和空间全转录组分析。
再利用空间多组学数据构建预测模型,实现对NSCLC患者无进展生存期(PFS)的精准分层与预后评估。
03 主要发现
1、免疫反应的双重细胞特征
利用空间蛋白组数据,研究团队对患者肿瘤组织中的多种细胞类型进行分析,识别出两类与免疫治疗结局密切相关的空间细胞组合。一种是“抗药性生态位”,主要由增殖型肿瘤细胞、粒细胞及血管内皮细胞构成,集中分布于肿瘤区域,该组合的高比例与患者较短的无进展生存期(PFS)显著相关,提示肿瘤的高增殖状态和炎性血管化微环境共同促进免疫逃逸。另一种是“应答性生态位”,主要由M1/M2型巨噬细胞与CD4⁺ T细胞构成,富集于基质区,其增加与更长的PFS显著相关,表明免疫支持性基质有助于激发有效的抗肿瘤反应。
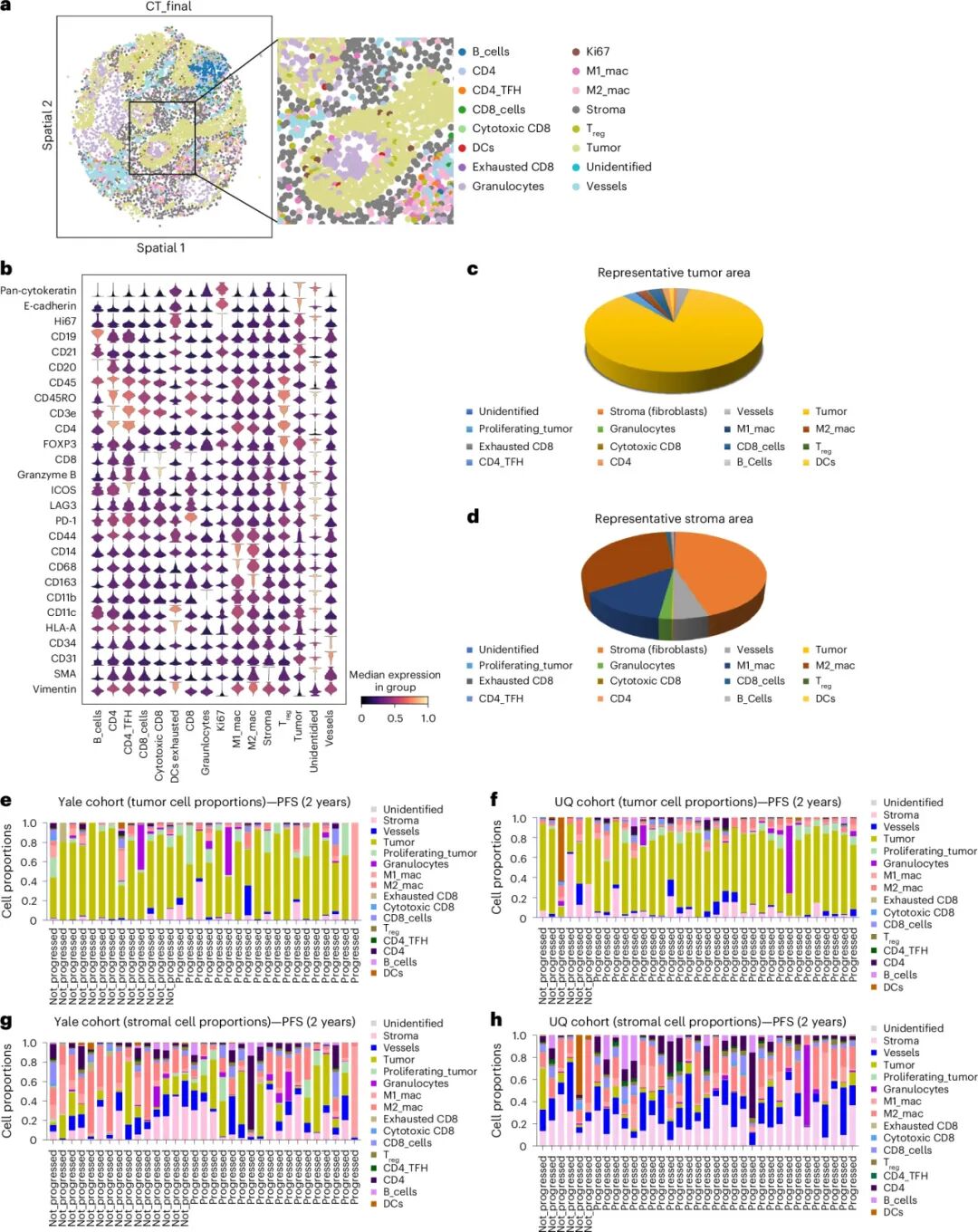 肿瘤区与基质区细胞类型组成及与PFS的相关性
肿瘤区与基质区细胞类型组成及与PFS的相关性2、免疫微环境中的细胞分布规律
进一步分析患者在不同免疫状态下的细胞互作规律。结果显示,在进展患者中,“抗药性生态位”更常见,其中B细胞和树突状细胞(DC)的富集交互与疾病进展显著相关,提示促肿瘤微环境;而在非进展患者中“应答性生态位”占主导地位,M2巨噬细胞与CD4⁺/CD8⁺ T细胞的交互显著增强,支持其免疫调控的作用。该发现进一步证实,免疫治疗反应不仅取决于细胞类型比例,还与肿瘤微环境中特定细胞生态位的形成及其交互强度密切相关。
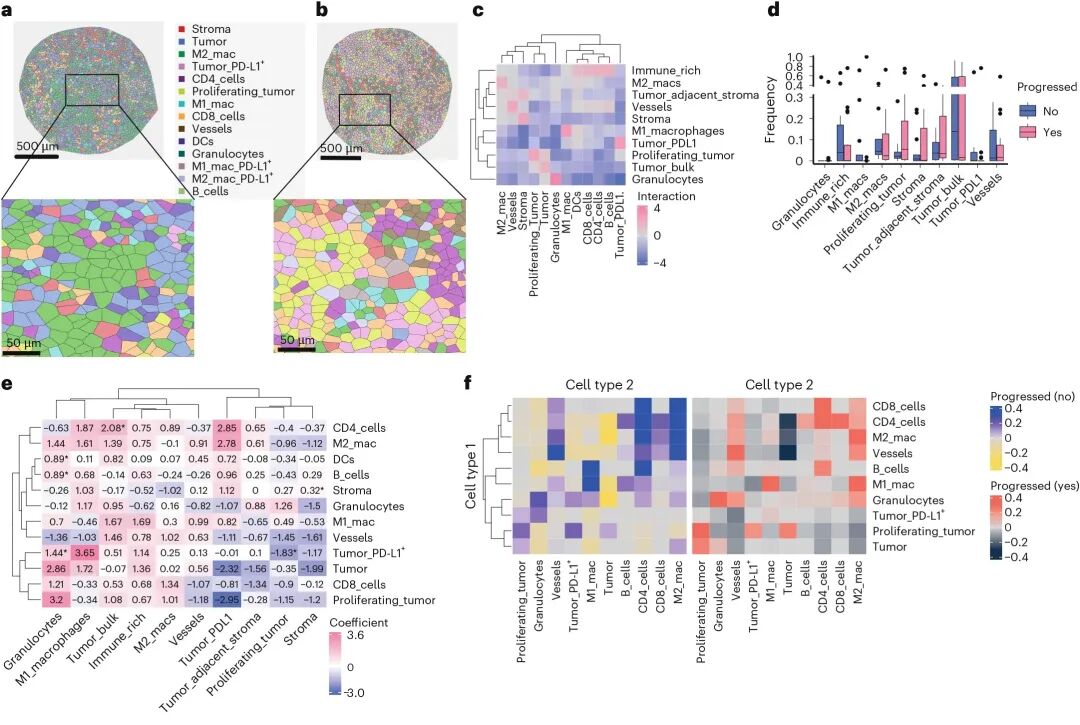 细胞定位与交互:抵抗 vs 响应生态位
细胞定位与交互:抵抗 vs 响应生态位3、PD-L1的空间分布对治疗反应的预测意义
研究者利用空间蛋白组平台评估了PD-L1在不同细胞类型上的表达价值。结果显示,巨噬细胞上的PD-L1表达水平与患者获得长期临床获益的相关性更强,而肿瘤细胞上的PD-L1则未显示稳定的预测作用。说明免疫细胞表达的PD-L1可能参与抗原呈递与免疫调节,其存在与免疫治疗反应的改善密切相关。
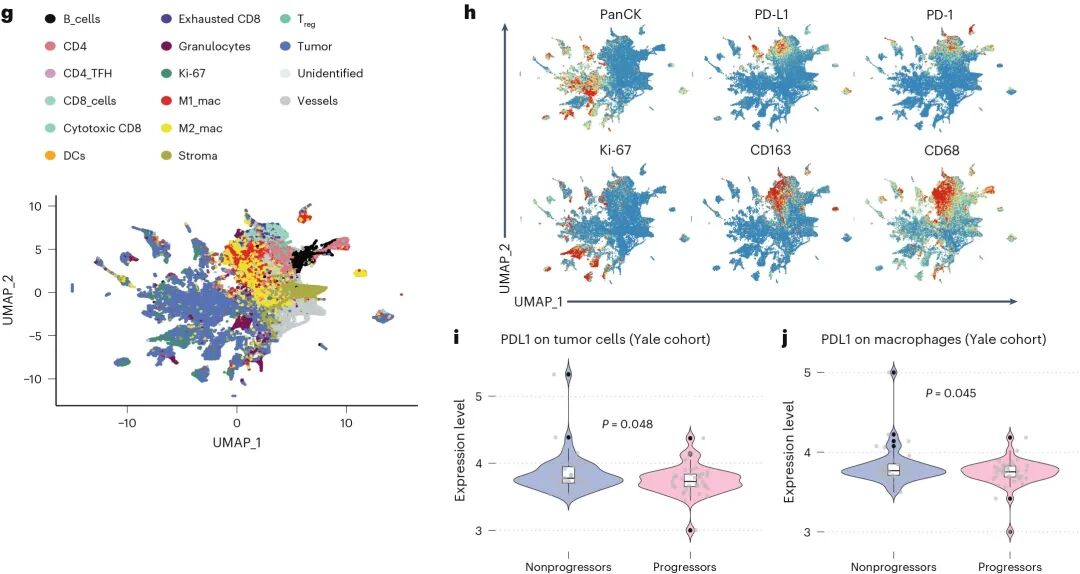 巨噬细胞PD-L1表达与PFS正相关
巨噬细胞PD-L1表达与PFS正相关4、空间转录组揭示细胞到基因的功能对应
在GeoMx DSP平台上,研究者对患者的肿瘤区与基质区进行了分区测序,结合解卷积算法建立cell-to-gene映射模型。分析发现,抗药性细胞群对应的基因集合(如KRT7、KRT18、FZD6、CD24)显著富集于上皮——间质转化和细胞迁移相关通路,提示其与肿瘤侵袭性增强有关;而应答性细胞群对应的基因集合(如SIGLEC1、CXCL9、CCL8、MRC1)富集于免疫活化与趋化信号通路,代表更强的免疫反应能力。这两类cell-to-gene模型在独立队列中均获得验证,证实了该模型的稳健性与预测潜力。
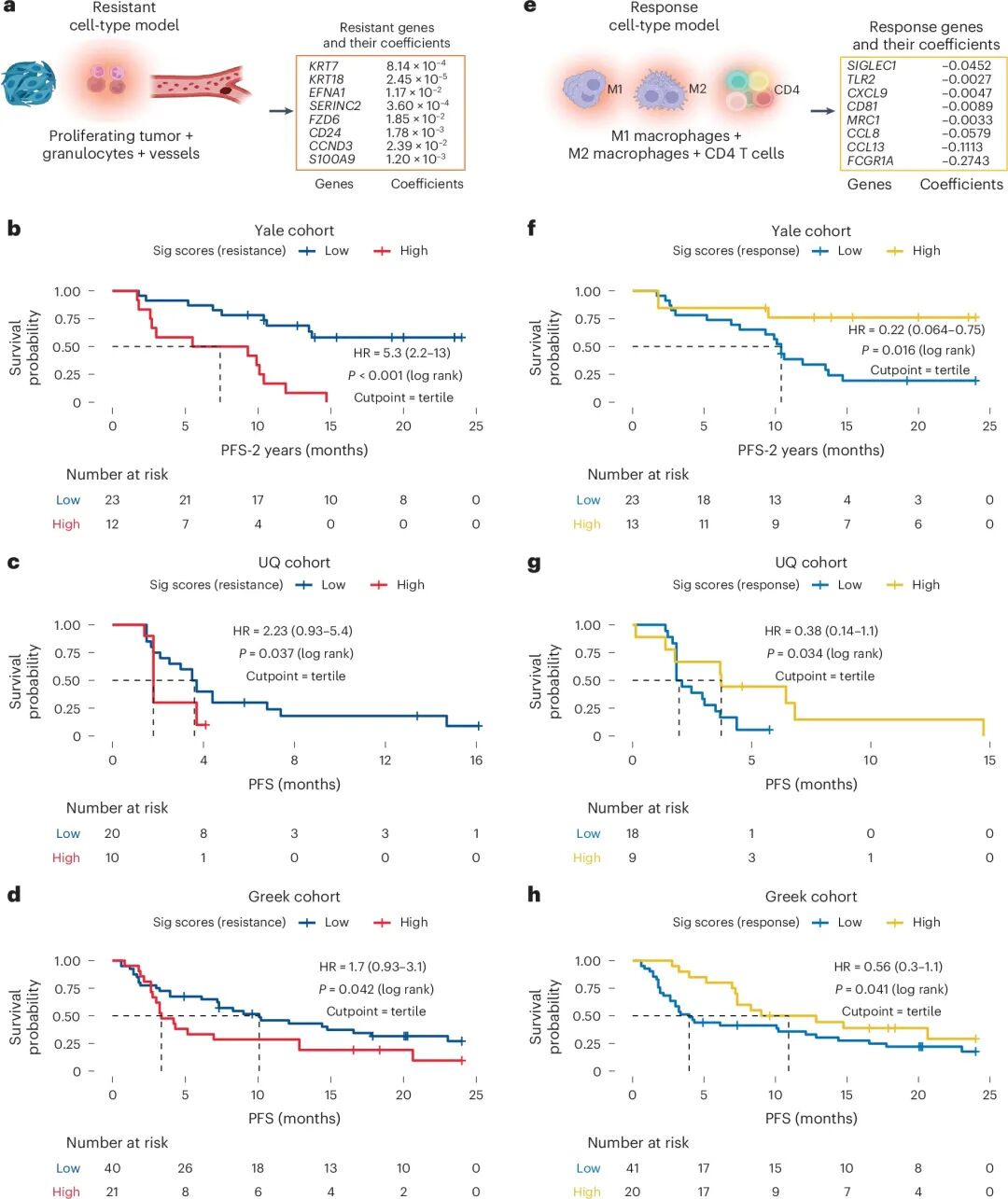 cell-to-gene模型的构建及跨队列验证
cell-to-gene模型的构建及跨队列验证04 总结
本研究利用 PCF-CODEX 空间蛋白组平台 与 GeoMx DSP 空间转录组平台,构建了非小细胞肺癌(NSCLC)对免疫治疗反应的系统性空间模型,揭示了肿瘤免疫微环境在疗效差异中的关键作用。空间多组学平台协同作用,不仅在空间维度上构建了cell-to-gene关联网络,揭示免疫反应的分子驱动机制,还为精准预测患者反应、优化免疫治疗决策提供了新的思路与技术路径。

