表达早老蛋白的内皮细胞无法适应剪切应力
2025-11-07 来源:本站 点击次数:82Progerin-expressing endothelial cells are unable to adapt to shear stress
Keywords: HGPS; ECs; fluid shear stress; lamin A; ZMPSTE24; cell loss; nuclear abnormalities; lonafarnib; methylstat.
核纤层作为核膜内膜与染色质间的纤维蛋白网络,具有支持细胞核结构、影响核形态、基因调控及细胞分裂时核组装解体等作用,且在力作用下有机械适应和响应特性。早老症(HGPS)由 LMNA 基因的常染色体显性突变引发,该突变导致异常早老蛋白产生,其因缺失特定切割位点而yongjiu法尼基化,这是该病关键特征,ZMPSTE24 敲除小鼠的表现可佐证。早老蛋白在核周积累,会改变核纤层结构,引发核形态异常、硬度增加、异染色质重分布等一系列核缺陷。
点击了解:流体剪切应力系统
HGPS 患者会因加速性动脉粥样硬化引发心脏病、中风等导致早逝,其心血管异常与衰老个体的动脉粥样硬化表现相似,但不存在传统危险因素。目前关键问题是早老蛋白如何影响血管系统引发快速动脉粥样硬化。研究发现,该病特征之一是大动脉血管平滑肌细胞丢失,而血管平滑肌细胞中早老蛋白的表达会损害细胞增殖、削弱对生理牵张力的响应、降低血管反应性,并通过诱导内质网应激加速动脉粥样硬化。早老蛋白还会影响内皮细胞功能,相关小鼠模型显示其会引发炎症、血管形成受损、心脏病变等,且内皮细胞机械响应能力受损。
点击了解:细胞力学刺激培养系统
基于此,弗吉尼亚联邦大学生物医学工程系的研究团队通过建立早老症细胞模型发现,表达早老蛋白或 ZMPSTE24 敲低的内皮细胞无法适应生理水平流体剪切应力,会出现细胞丢失,而特定抑制剂处理或预先让细胞适应剪切应力可缓解这一情况。这表明内皮细胞因早老蛋白表达而无法适应流体剪切应力的机械力,可能是早老症患者动脉粥样硬化快速发生的重要原因。研究成果发表在Biomedical Journal期刊,题为“Progerin-expressing endothelial cells are unable to adapt to shear stress”。

首先,研究人员探讨了早老蛋白表达对内皮细胞响应流体剪切应力的影响,发现表达早老蛋白或过表达野生型核纤层蛋白 A 的人脐静脉内皮细胞,在12 dynes/cm² 剪切应力作用 72 小时后细胞数量显著减少(图 1A 和 B),蛋白质印迹法用于证实核纤层蛋白 A 和早老蛋白的过表达(图 1C),而 24 小时时细胞损失极小,且静态培养中无细胞损失,说明细胞损失并非快速发生,且依赖于流体剪切应力。同时,表达早老蛋白的细胞在剪切应力作用 24 小时后出现大量磷脂酰丝氨酸表面表达(图 1D),这表明凋亡先于细胞损失发生。
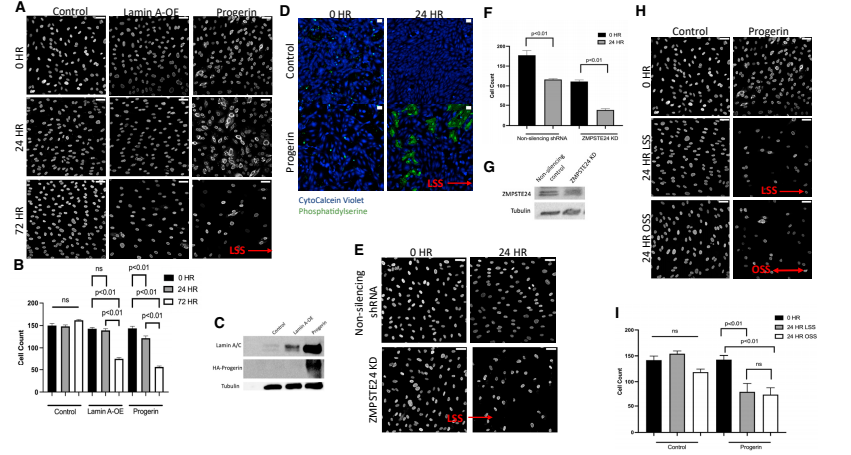
图1 早老蛋白的表达会导致 HUVECs 在层流剪切应力下发生细胞损失。
接着,研究人员通过 shRNA 敲低人脐静脉内皮细胞中 ZMPSTE24 构建早老症模型,发现该细胞 ZMPSTE24 含量减少 40%(图 1G),出现核褶皱增多及剪切应力下细胞损失等类似早老症的特征(图 1E 和 F)。此外,将表达早老蛋白的细胞置于层流和振荡剪切应力中,未发现不同流型导致细胞损失有显著差异(图 1H 和 I)。这些结果表明,核纤层蛋白 A 过表达或早老蛋白表达会影响内皮细胞对流体流动作用力的适应能力。
接下来,研究人员发现,表达早老蛋白的内皮细胞在流动和静态条件下均存在核形态异常,这与早老症细胞核纤层机械应力下重排能力降低相关。通过量化分析,表达早老蛋白的内皮细胞存在核纤层畸形(图2A)、核向外囊泡(图 2B)、微核(图 2C)等核异常,且核纤层蛋白 B 结构被破坏,同时这些核异常在剪切应力(图 2D)和静态条件(图 2E)下的发生水平相近,与非内皮细胞类型中的早老症相关观察结果一致。
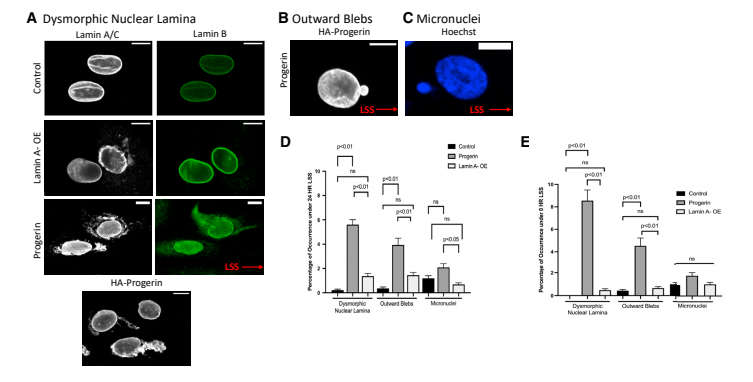
图2 层流剪切应力会导致表达早老蛋白的 HUVECs 出现核膜破坏。
表达早老蛋白的细胞因法尼基附着导致核膜叶状化,而洛那法尼作为法尼基转移酶抑制剂,可阻止早老蛋白积累并改善核形态。研究人员用洛那法尼处理 ZMPSTE24 敲低细胞和表达早老蛋白的内皮细胞后发现,其能显著减少 ZMPSTE24 敲低细胞在剪切应力下的损失(图 3A 和 B),但对表达早老蛋白的细胞损失无显著改善。此外,其还可防止表达早老蛋白的细胞出现核膜破坏(图 3C 和 D)。这表明洛那法尼能增强细胞对机械力变化的响应和适应能力。

图3 洛那法尼可逆转剪切应力下表达早老蛋白的 HUVECs 的细胞损失和核膜破坏。
表达早老蛋白的细胞存在组蛋白修饰异常,而药物诱导异染色质增加可改善其核形态。研究人员用组蛋白三甲基去甲基化酶抑制剂甲基化抑制剂(methylstat)处理 ZMPSTE24 敲低及表达早老蛋白的内皮细胞后发现,在剪切应力作用下,这些细胞的损失(图 4A 和 B)和核膜破坏均被阻止(图 4C 和 D)。这表明,增加表达早老蛋白的内皮细胞的 DNA 甲基化水平,可逆转其核形态并恢复对剪切应力的适应能力。

图4 甲基化抑制剂可逆转剪切应力下表达早老蛋白的HUVECs 及 ZMPSTE24 敲低细胞的细胞损失。
最后,研究人员推测,无需经历细胞和核形态变化的表达早老蛋白的内皮细胞受剪切应力影响更小。为了探究早老蛋白的表达会如何影响已排列的内皮细胞,研究人员通过将未转导的内皮细胞暴露于剪切应力中 72 小时以诱导其排列 ,再转导早老蛋白并继续暴露于剪切应力72 小时。结果显示,与未适应剪切应力的表达早老蛋白的细胞(图 5B)相比,预先排列的细胞中表达早老蛋白(图 5A)可减少细胞损失(图 5C)并减少核膜破坏(图 5D)。这些结果表明,表达早老蛋白的人脐静脉内皮细胞预先排列可防止剪切应力下的细胞损失。

图5 表达早老蛋白的HUVECs 预先排列可防止剪切应力下的细胞损失。
总之,该研究表明,核纤层的变化(如早老蛋白表达、核纤层蛋白 A 过表达或 ZMPSTE24 缺失)会影响内皮细胞对流体剪切应力的正常适应能力,这可能是早老症患者动脉粥样硬化快速发生的重要原因,同时也凸显了核纤层在内皮细胞机械适应中的关键作用。
参考文献:Danielsson BE, Peters HC, Bathula K, Spear LM, Noll NA, Dahl KN, Conway DE. Progerin-expressing endothelial cells are unable to adapt to shear stress. Biophys J. 2022 Feb 15;121(4):620-628. doi: 10.1016/j.bpj.2022.01.004. Epub 2022 Jan 6. PMID: 34999130; PMCID: PMC8873939.
原文链接:https://pmc.ncbi.nlm.nih.gov/articles/PMC8873939/
图片来源:所有图片均来源于参考文献
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!进入官网www.naturethink.com或关注“Naturethink”公众号,了解更多相关内容。
点击了解:流体剪切应力系统
点击了解:细胞力学刺激培养系统

