Nature子刊:香港理工大学团队揭示肝癌免疫治疗耐药新机制
2025-12-22 来源:本站 点击次数:58肝细胞癌是世界上第三大致命性癌症和第六大常见癌症。近年来,免疫检查点抑制剂(ICIs)在晚期HCC治疗中展现出潜力,提高了存活率,但仅部分患者受益。越来越多的证据表明,致癌通路的激活会导致肿瘤免疫微环境(TIME)恶化,最终引发免疫治疗抵抗。2025年11月11日,香港理工大学Terence Kin Wah Lee团队在Nature Communications(IF 15.7)上发表了题为“Wild-type KRAS activation drives evasion of interferon-mediated immunity and resistance to immunotherapy in hepatocellular carcinoma”的文章。研究揭示了野生型KRAS在免疫逃逸的小鼠肝癌中的作用,靶向野生型KRAS信号结合ICIS可能是晚期肝癌患者的一种有效治疗策略。

本研究Lv-Kras由维真生物助力提供
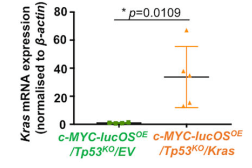
RT-qPCR验证c-MYC-lucOSOE/Tp53KO/Kras肿瘤野生型Kras mRNA的过表达
研究结果分享
1、野生型KRAS过表达消除c-MYC-LucOE/Tp53KO模型中的抗肿瘤T细胞反应并促进免疫逃避
研究人员构建了一个具有免疫活性的c-MYC-LucOE/Tp53KO 小鼠肝癌模型,模拟T细胞对肿瘤的识别与攻击,结果发现抗肿瘤T细胞反应未能清除所有小鼠的肿瘤细胞,20%的小鼠出现肿瘤,这表明部分逃避了T细胞的监视。DIA蛋白质组学分析显示c-MYC-LucOE/Tp53KO 肝癌免疫逃避小鼠模型中致癌KRAS信号丰富,并且野生型KRAS在肝癌组织中表达上调,与不良预后有关。为了验证KRAS信号促进免疫逃避的假设,研究人员在c-MYC-LucOE/Tp53KO 肝癌中过表达了野生型Kras。值得注意的是,所有c-MYC-lucOSOE/Tp53KO/Kras 小鼠发生的肿瘤在形态和分子特征上都显示出肝癌的表型,表明完全逃脱了免疫监视。进一步实验表明,在EGF刺激下,野生型KRAS过表达通过激活EGFR/KRAS/ERK轴促进免疫逃避。
1、野生型KRAS过表达消除c-MYC-LucOE/Tp53KO模型中的抗肿瘤T细胞反应并促进免疫逃避
研究人员构建了一个具有免疫活性的c-MYC-LucOE/Tp53KO 小鼠肝癌模型,模拟T细胞对肿瘤的识别与攻击,结果发现抗肿瘤T细胞反应未能清除所有小鼠的肿瘤细胞,20%的小鼠出现肿瘤,这表明部分逃避了T细胞的监视。DIA蛋白质组学分析显示c-MYC-LucOE/Tp53KO 肝癌免疫逃避小鼠模型中致癌KRAS信号丰富,并且野生型KRAS在肝癌组织中表达上调,与不良预后有关。为了验证KRAS信号促进免疫逃避的假设,研究人员在c-MYC-LucOE/Tp53KO 肝癌中过表达了野生型Kras。值得注意的是,所有c-MYC-lucOSOE/Tp53KO/Kras 小鼠发生的肿瘤在形态和分子特征上都显示出肝癌的表型,表明完全逃脱了免疫监视。进一步实验表明,在EGF刺激下,野生型KRAS过表达通过激活EGFR/KRAS/ERK轴促进免疫逃避。
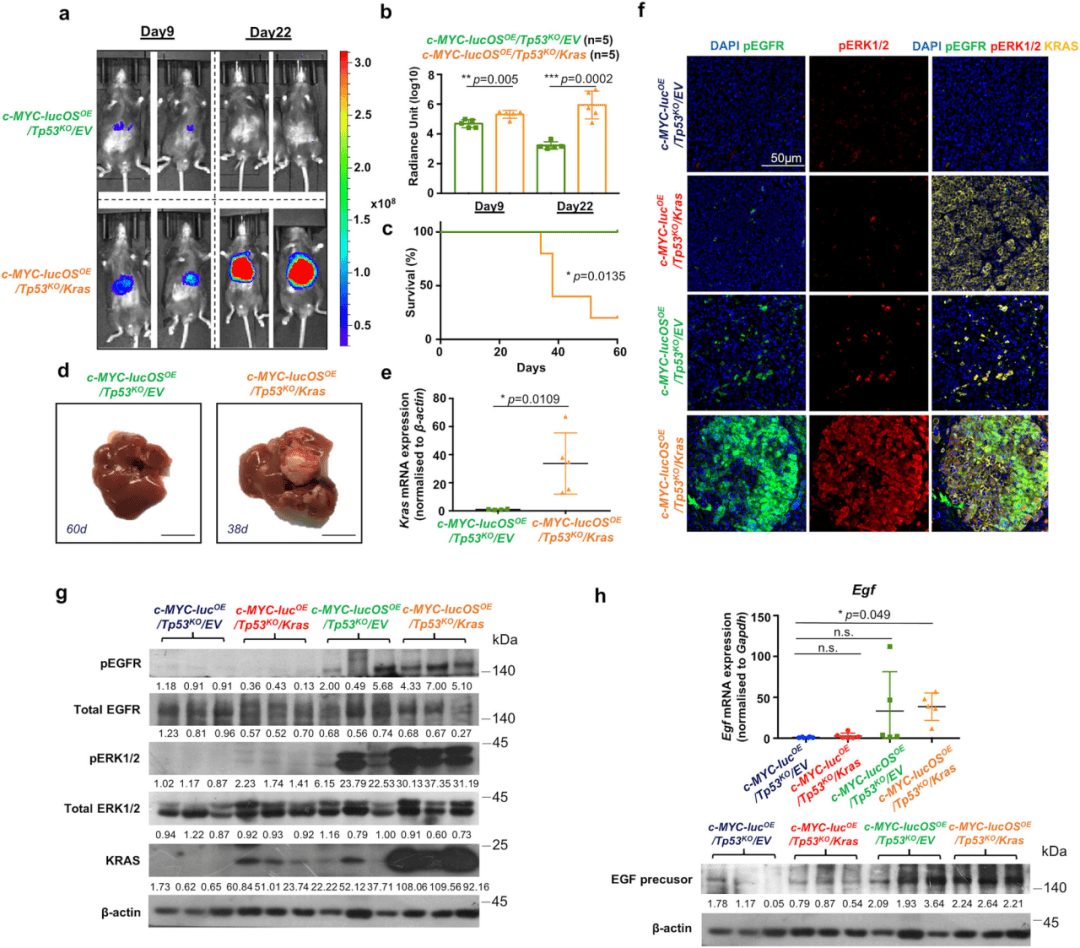
图1. 野生型Kras过表达激活EGF/EGFR/KRAS/ERK信号通路驱动免疫逃避
2、野生型KRAS激活通过抑制DC和T细胞向肿瘤部位的募集来促进免疫逃避
通过单细胞RNA测序比较c-MYC-lucOSOE/Tp53KO/EV 和c-MYC-lucOSOE/Tp53KO/Kras 小鼠的肿瘤免疫微环境,发现野生型KRAS过表达肿瘤的免疫表型发生显著重塑,免疫抑制性髓系细胞群、抗肿瘤T细胞和自然杀伤(NK)细胞显著减少。野生型KRAS发挥免疫抑制作用,包括下调干扰素反应和淋巴细胞趋化性,以及抗原处理和递呈。为了研究野生型KRAS如何调节适应性免疫,跟踪了HTVI后前两周上述小鼠的生物发光信号和SIINFEKL特异性CD8+T细胞的变化,发现c-MYC-lucOSOE/Tp53KO/EV 组在第二周的生物发光信号开始减弱,表明抗肿瘤免疫应答启动,且可检测到SIINFEKL特异性CD8+T细胞,进一步支持了抗原特异性反应。与单细胞测序研究结果一致,过表达KRAS的肝脏在适应性免疫中表现出严重的缺陷,其特征是主要的免疫抑制髓系细胞、T细胞募集受损和DC功能障碍。
通过单细胞RNA测序比较c-MYC-lucOSOE/Tp53KO/EV 和c-MYC-lucOSOE/Tp53KO/Kras 小鼠的肿瘤免疫微环境,发现野生型KRAS过表达肿瘤的免疫表型发生显著重塑,免疫抑制性髓系细胞群、抗肿瘤T细胞和自然杀伤(NK)细胞显著减少。野生型KRAS发挥免疫抑制作用,包括下调干扰素反应和淋巴细胞趋化性,以及抗原处理和递呈。为了研究野生型KRAS如何调节适应性免疫,跟踪了HTVI后前两周上述小鼠的生物发光信号和SIINFEKL特异性CD8+T细胞的变化,发现c-MYC-lucOSOE/Tp53KO/EV 组在第二周的生物发光信号开始减弱,表明抗肿瘤免疫应答启动,且可检测到SIINFEKL特异性CD8+T细胞,进一步支持了抗原特异性反应。与单细胞测序研究结果一致,过表达KRAS的肝脏在适应性免疫中表现出严重的缺陷,其特征是主要的免疫抑制髓系细胞、T细胞募集受损和DC功能障碍。
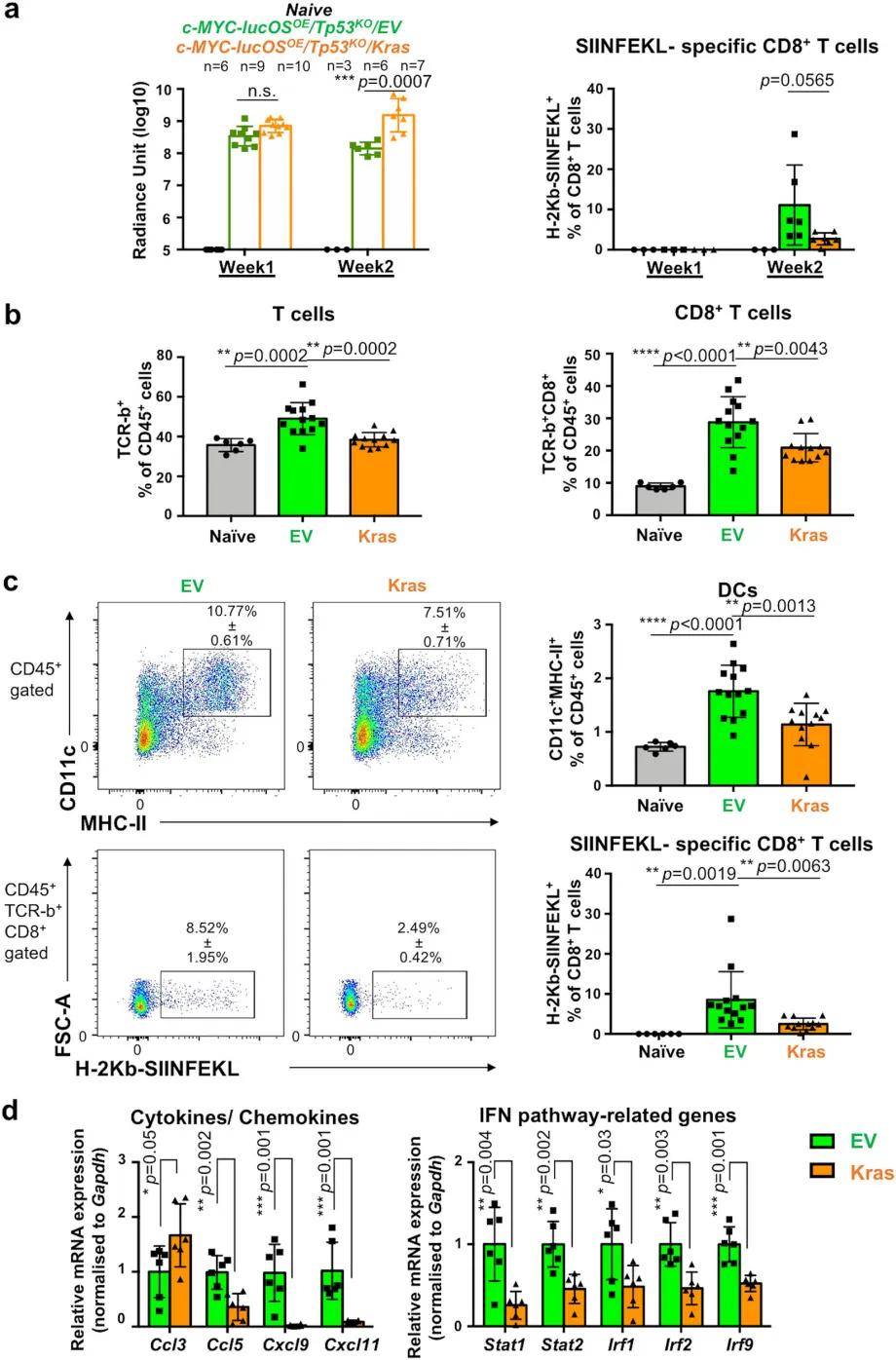
图2. c-MYC-lucOSOE/Tp53KO 模型中KRAS过表达抑制树突状细胞和T细胞募集
3、体内MEK1/2敲除挽救野生型KRAS介导的免疫抑制性肿瘤免疫微环境并增强干扰素应答
研究人员发现KRAS激活抑制肝癌中干扰素诱导的MHC-I 表达,为了验证MEK/ERK信号是否介导KRAS依赖的免疫逃避,使用CRISPR/Cas9系统在体内敲除MEK1/2。HTVI后第5天,所有组的荧光素酶信号相当;但第16天,MEK1/2敲除有效缓解KRAS介导的肿瘤进展。c-MYC-lucOSOE/Tp53KO/Kras/NTC 小鼠均逃脱免疫监视,而c-MYC-lucOSOE/Tp53KO/Kras/MEKKO 组仅8只小鼠中的6只发生肿瘤,且肿瘤体积更小、结节更少。分子分析证实MEKKO肿瘤中的KRAS/MEK/ERK信号及下游分子(Ccnd1和Dusp6)被有效抑制。MEK敲除可恢复干扰素信号,上调干扰素相关基因及T细胞趋化因子Cxcl9和Cxcl10的表达。多重IHC显示,MEKKO肿瘤中CD11c+ DC浸润增加,且与H-2Kb-SIINFEKL表达共定位;CD8+T细胞靠近 CXCL9+CD11c+ DC,CD8+T 细胞浸润增加,提示MEK阻断促进DC产生CXCL9,从而在一定时间内促进CD8+T细胞的募集。进一步研究发现在抗PD-1耐药临床标本和肝细胞癌模型中存在KRAS信号的激活,MRTX0902和曲美替尼联合抗PD-1抑制c-MYC-lucOSOE/Tp53KO/Kras小鼠模型的肿瘤生长,并提高存活率。
研究人员发现KRAS激活抑制肝癌中干扰素诱导的MHC-I 表达,为了验证MEK/ERK信号是否介导KRAS依赖的免疫逃避,使用CRISPR/Cas9系统在体内敲除MEK1/2。HTVI后第5天,所有组的荧光素酶信号相当;但第16天,MEK1/2敲除有效缓解KRAS介导的肿瘤进展。c-MYC-lucOSOE/Tp53KO/Kras/NTC 小鼠均逃脱免疫监视,而c-MYC-lucOSOE/Tp53KO/Kras/MEKKO 组仅8只小鼠中的6只发生肿瘤,且肿瘤体积更小、结节更少。分子分析证实MEKKO肿瘤中的KRAS/MEK/ERK信号及下游分子(Ccnd1和Dusp6)被有效抑制。MEK敲除可恢复干扰素信号,上调干扰素相关基因及T细胞趋化因子Cxcl9和Cxcl10的表达。多重IHC显示,MEKKO肿瘤中CD11c+ DC浸润增加,且与H-2Kb-SIINFEKL表达共定位;CD8+T细胞靠近 CXCL9+CD11c+ DC,CD8+T 细胞浸润增加,提示MEK阻断促进DC产生CXCL9,从而在一定时间内促进CD8+T细胞的募集。进一步研究发现在抗PD-1耐药临床标本和肝细胞癌模型中存在KRAS信号的激活,MRTX0902和曲美替尼联合抗PD-1抑制c-MYC-lucOSOE/Tp53KO/Kras小鼠模型的肿瘤生长,并提高存活率。
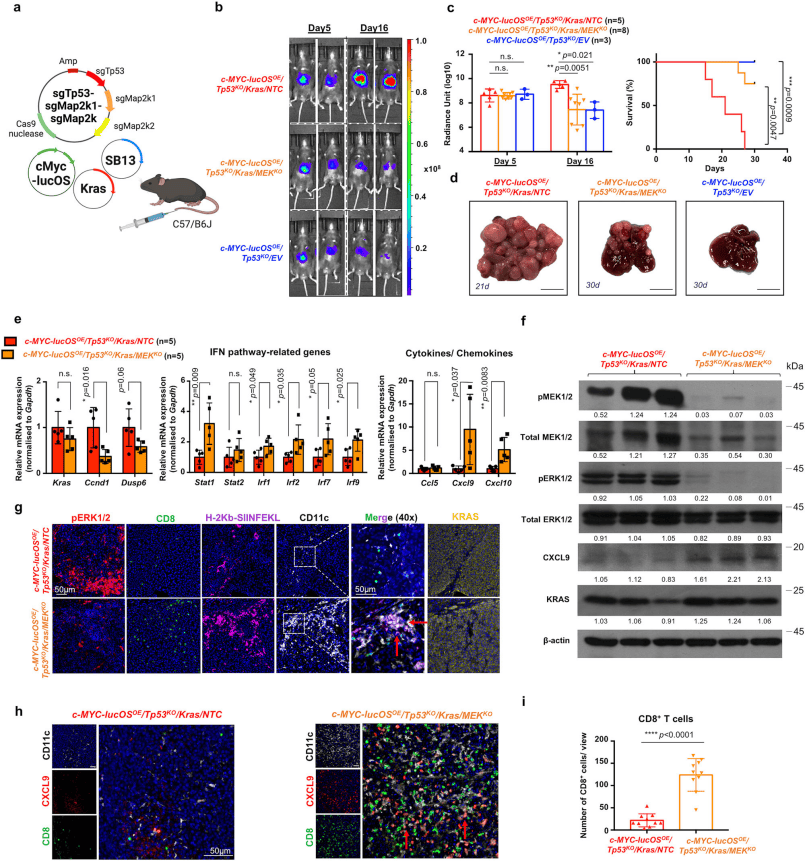
图3.体内MEK1/2敲除挽救野生型KRAS介导的免疫抑制性肿瘤免疫微环境并增强干扰素应答
结论
本研究强调了野生型KRAS通过抑制干扰素信号和MHC-I抗原递呈在推动免疫逃避中的作用,并有助于抵抗抗PD-1治疗,联合靶向KRAS/ERK信号和抑制PD-1可能是一种新的治疗肝癌的策略。
本研究强调了野生型KRAS通过抑制干扰素信号和MHC-I抗原递呈在推动免疫逃避中的作用,并有助于抵抗抗PD-1治疗,联合靶向KRAS/ERK信号和抑制PD-1可能是一种新的治疗肝癌的策略。
相关文章
更多 >

